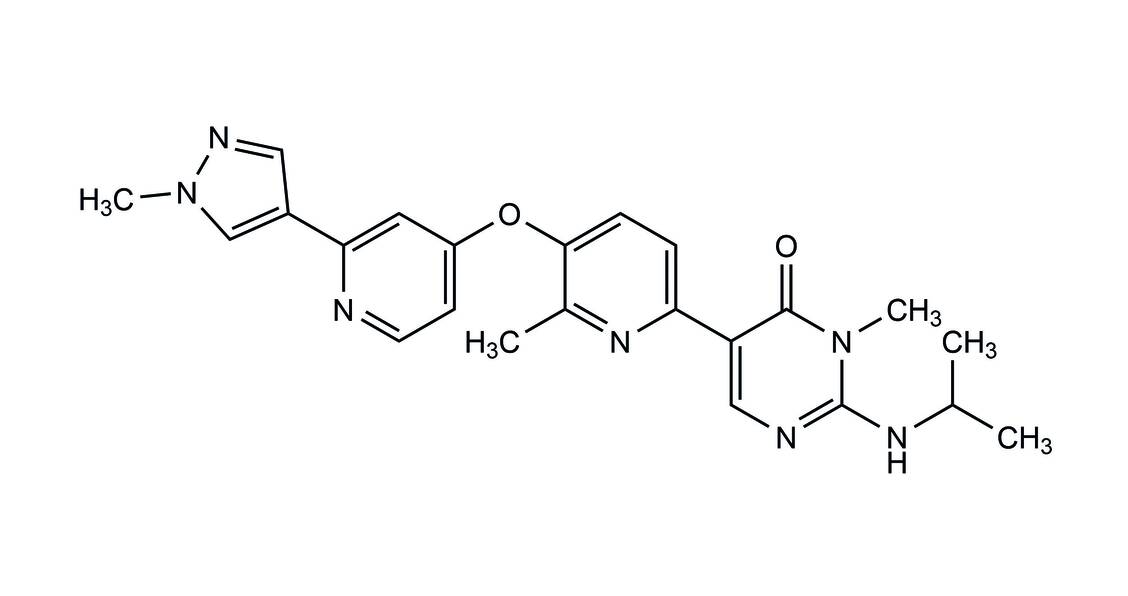
Die empfohlene Dosis beträgt 30 mg Vimseltinib zweimal wöchentlich im Abstand von mindestens 72 Stunden.
Bei Unverträglichkeiten wie zum Beispiel Juckreiz, der bei 27 Prozent der Behandelten auftrat, kann die Dosis stufenweise auf 20 mg beziehungsweise 14 mg zweimal wöchentlich reduziert werden. Bei Patienten, die auch 14 mg nicht vertragen, sollte die Therapie abgesetzt werden.
Die Hartkapseln können unabhängig von den Mahlzeiten eingenommen werden. Sie sind unzerkaut und unversehrt zu schlucken. Beschädigte Kapseln dürfen nicht verwendet werden. Die Behandlung wird fortgesetzt, solange der Patient davon einen Nutzen hat und keine inakzeptable Toxizität auftritt. Hat der Patient die Einnahme vergessen und sind seit dem vorgesehenen Einnahmezeitpunkt weniger als 48 Stunden verstrichen, sollte die vergessene Dosis so bald wie möglich eingenommen und die nächste Dosis zum üblichen Zeitpunkt eingenommen werden. Sind bereits mehr als 48 Stunden verstrichen, ist die vergessene Dosis auszulassen und die nächste Dosis zum üblichen Zeitpunkt einzunehmen.
Bei Patienten mit vorbestehenden erhöhten Serumtransaminasen, erhöhtem Gesamtbilirubin/erhöhtem direkten Bilirubin oder akuter Leber- beziehungsweise Gallenwegserkrankung ist die Behandlung mit Vimseltinib zu vermeiden. Die Leberfunktion sollte vor Behandlungsbeginn, einmal monatlich während der ersten zwei Monate und danach vierteljährlich während des ersten Behandlungsjahres überprüft werden.
Bei mäßig oder stark eingeschränkter Leberfunktion sowie stark eingeschränkter Nierenfunktion sollte Vimseltinib ebenfalls nicht zum Einsatz kommen.
Die Langzeitsicherheit von Romvimza ist derzeit nicht abschließend beurteilbar. Dies betrifft vor allem die langfristigen Auswirkungen der Makrophagen-Depletion auf Leber, Haut, zentrales Nervensystem und Knochenmark.