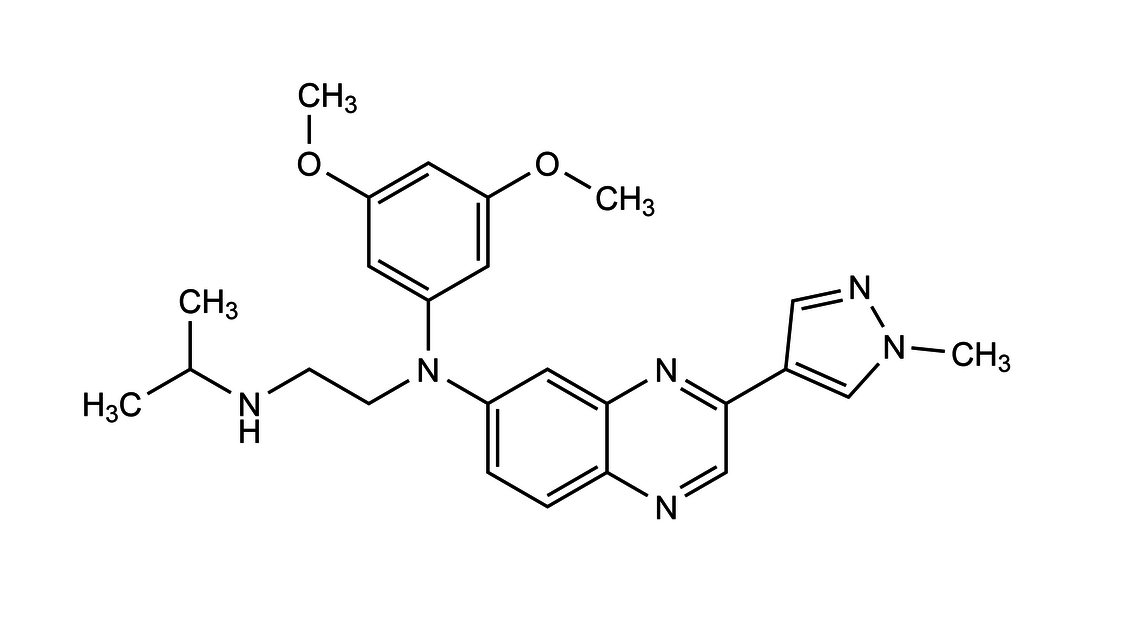
Erdafitinib wird einmal pro Tag oral eingenommen. Die empfohlene Anfangsdosis von 8 mg kann je nach Verträglichkeit und Serumphosphatspiegel auf 9 mg erhöht werden. Zur Dosierung finden sich in der Fachinformation weitere Details. Denn abhängig vom Serumphosphatspiegel und dem Auftreten von Nebenwirkungen können Dosisanpassungen notwendig werden.
Unter der Therapie mit Erdafitinib soll die Phosphatzufuhr über die Nahrung (600 bis 800 mg täglich) eingeschränkt werden. Die gleichzeitige Anwendung von Wirkstoffen, die den Phosphatspiegel erhöhen können, soll bei Spiegeln ≥ 5,5 mg/dl vermieden werden. Eine Supplementierung mit Vitamin D wird bei Patienten, die Erdafitinib erhalten, nicht empfohlen, da sie möglicherweise zu erhöhten Serumphosphat- und Calciumspiegeln beiträgt.
Erdafitinib kann Augenerkrankungen auslösen. Sehr häufig sind zum Beispiel trockenes Auge und zentrale seröse Retinopathie. Vor Beginn der Behandlung mit Balversa und in regelmäßigen Abständen unter der Therapie sollten augenärztliche Untersuchungen erfolgen. Alle Patienten sollten zudem eine Prophylaxe oder Behandlung gegen Augentrockenheit erhalten, und zwar mindestens alle zwei Stunden während der Wachzeiten.
Auch Haut-, Nagel- und Schleimhauterkrankungen sowie Lichtempfindlichkeitsreaktionen sind möglich. Hauterkrankungen wie trockene Haut und palmar-plantares Erythrodysästhesie-Syndrom (PRES) sind sehr häufig, ebenso Nagelerkrankungen, einschließlich Onycholyse, Nagelverfärbung und Paronychie. Schleimhauterkrankungen wie Stomatitis und Mundtrockenheit treten ebenfalls sehr häufig auf. Wegen des potenziellen Risikos phototoxischer Reaktionen ist bei Sonnenexposition Vorsicht geboten, indem schützende Kleidung getragen wird und/oder Sonnenschutzmittel aufgetragen wird.
Bei Patienten mit schwerer Nieren- oder Leberfunktionsstörung sollte eine Behandlungsalternative zu Erdafitinib in Betracht gezogen werden.