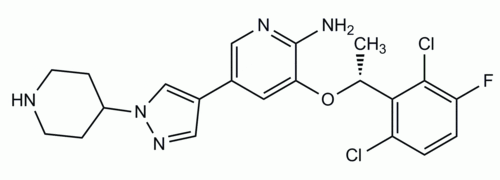
Die empfohlene Dosis von Xalkori beträgt für Erwachsene zweimal täglich 250 mg. Die Kapseln sollten als Ganzes geschluckt und weder geöffnet noch aufgelöst werden. Bei bestimmten Nebenwirkungen können Dosisanpassungen erforderlich werden. Diese können in einer Reduktion der Dosis auf 200 mg oder in einer Verlängerung des Dosisintervalls bestehen.
Die empfohlenen Dosierungen für Kinder und Jugendliche richten sich nach der Körperoberfläche. Die granulathaltigen Kapseln müssen geöffnet werden. Das Granulat kann dann direkt in den Mund oder mit einer trockenen Einnahmehilfe, zum Beispiel einem Löffel, verabreicht werden. Anschließend ist ausreichend Wasser zu trinken. Das Granulat in den Kapseln zum Öffnen darf nicht gekaut, zerdrückt oder auf Nahrungsmittel gestreut werden. Die Kapselhülle darf nicht geschluckt werden.
Bei Patienten mit einer Lebenfunktionsstörung sollte Crizotinib unter Vorsicht angewendet werden. Bei Patienten mit mäßig schwerer oder schwerer Leberfunktionsstörung beziehungsweise mit starker Nierenfunktionsstörung ist eine Dosisanpassung erforderlich.
Crizotinib sollte außerdem nur mit Vorsicht zum Einsatz kommen, wenn Patienten bereits früher von einer QT-Zeit-Verlängerung betroffen waren, eine Prädisposition dafür haben oder Arzneimittel einnehmen, von denen bekannt ist, dass sie das QT-Intervall verlängern.
Falls eine Einnahme vergessen wurde, sollte der Patient sie nachholen, sofern bis zur nächsten geplanten Einnahme mindestens 6 Stunden liegen.
Grapefuit und Grapefruitsaft sowie Johanniskraut sollten während der Dauer der Therapie vermieden werden.