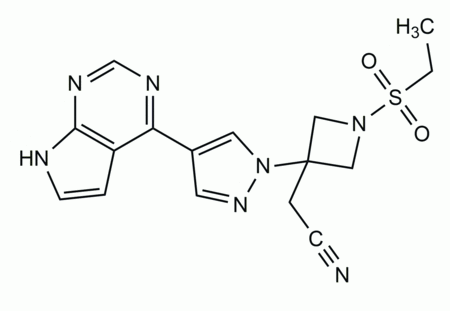
Die empfohlene Dosis zur Behandlung erwachsener Patienten beträgt 4 mg Baricitinib einmal täglich. Sie kann auf 2 mg einmal täglich reduziert werden, wenn die Krankheit unter Kontrolle ist. Die Dosis von 2 mg pro Tag ist zudem für Patienten über 65 Jahre, für solche mit chronischen oder rezidivierenden Infekten sowie für pädiatrische Patienten mit einem Körpergewicht von 10 bis unter 30 kg gedacht. Auch Patienten mit eingeschränkter Nierenfunktion sowie bei der gleichzeitigen Einnahme von Inhibitoren von Organischen Anionen-Transportern vom Typ 3 mit starkem Hemmpotenzial (OAT3-Hemmer) wie Probenecid sollte die 2-mg-Dosis gewählt werden.
Olumiant Filmtabletten können unabhängig von den Mahlzeiten und der Tageszeit eingenommen werden.
Nicht empfohlen wird die Anwendung bei Patienten mit schwerer Leberfunktionsstörung und einer Kreatinin-Clearance unter 30 ml/min.
Nicht begonnen werden sollte eine Behandlung bei Patienten mit hämatologischen Anomalien (absolute Neutrophilenzahl kleiner als 1 x 109 Zellen/l, absolute Lymphozytenzahl kleiner als 0,5 x 109 Zellen/l oder Hämoglobinwert kleiner als 8 g/dl). In den klinischen Studien wurden vermehrt Virusreaktivierungen beobachtet, etwa von Herpes-zoster- oder Herpes-simplex-Viren. Vor Therapiebeginn sollte daher entsprechend der Leitlinien ein Screening auf eine virale Hepatitis durchgeführt werden.
Baricitinib sollte bei bestimmten Patientengruppen nur angewendet werden, wenn keine geeigneten Behandlungsalternativen zur Verfügung stehen: Patienten ab 65 Jahren, Patienten mit einer atherosklerotischen Herz-Kreislauf-Erkrankung in der Vorgeschichte oder anderen kardiovaskulären Risikofaktoren (wie Raucher oder ehemalige Langzeitraucher) und Patienten mit Risikofaktoren für maligne Erkrankungen (zum Beispiel ein bestehendes Malignom oder ein Malignom in der Vorgeschichte).
Des Weiteren wurde in den Studien von Erhöhungen der Lipidwerte berichtet. Daher sollten nach Beginn der Therapie die Lipidparameter zwölf Wochen lang überprüft werden und die Patienten bei Bedarf mit einem Statin behandelt werden.
Die Anwendung von Baricitinib ist mit einer im Vergleich zu Placebo erhöhten Infektionsrate assoziiert. Daher sollten bei Patienten mit aktiven, chronischen oder wiederkehrenden Infektionen vor Therapiebeginn Nutzen und Risiken einer Olumiant-Behandlung sorgfältig abgewogen werden. Entwickelt der Patient unter der Einnahme eine Infektion, ist er sorgfältig zu überwachen und die Therapie vorübergehend zu unterbrechen. Sie darf erst wieder aufgenommen werden, wenn die Infektion vollständig ausgeheilt ist. Vor Therapiebeginn müssen die Patienten auf Tuberkulose getestet werden. Während oder unmittelbar vor einer Baricitinib-Behandlung sollte den Patienten kein attenuierter Lebendimpfstoff verabreicht werden.