Um genetische Information in die Zielzellen einzuschleusen, werden virale Vektoren verwendet. Diese sogenannte Transduktion kann ex vivo oder in vivo erfolgen. Für eine Gentherapie werden zwei Arten von Viren eingesetzt: Retroviren wie Lentiviren beziehungsweise Adeno- oder Herpesviren.
Um ein Virus als Vektor einzusetzen, muss es zunächst genetisch so modifiziert werden, dass nach Integration des therapeutischen Gens keine Viruspartikel gebildet werden, also das Virus sich nicht repliziert. Zu diesem Zweck werden die entsprechenden viralen Abschnitte des Erbmaterials entfernt.
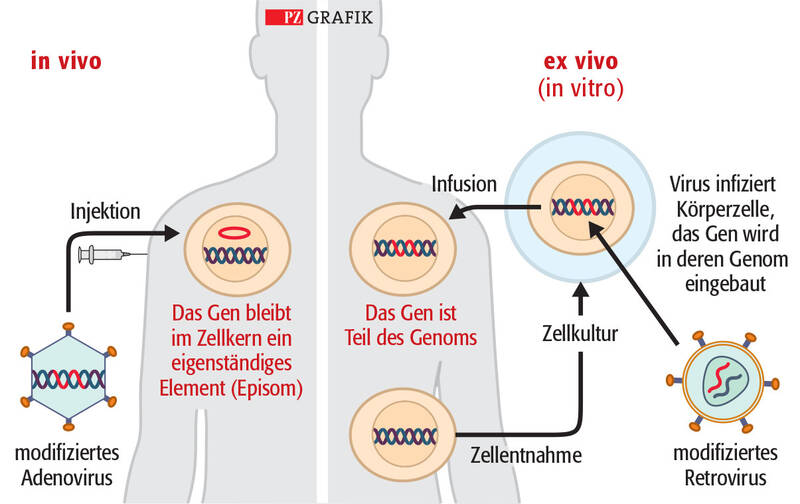
Bei der Ex-vivo-Gentherapie werden dem Patienten die Zielzellen zunächst entnommen. Mithilfe von Lentiviren, die sich nicht vermehren können, wird das therapeutische Gen stabil in die entnommenen Zellen integriert; das heißt, dass das Gen bei der Zellteilung an die Tochterzellen weitergegeben wird. Anschließend werden die in Zellkultur vermehrten modifizierten Zellen dem Patienten wieder verabreicht. Das Verfahren ist für Zellen geeignet, die sich relativ leicht aus dem Körper gewinnen lassen, zum Beispiel Stammzellen aus dem Knochenmark, und die sich anschließend replizieren.
Bei einer In-vivo-Gentherapie werden Viren, die das therapeutische Gen enthalten, direkt in den Körper des Patienten infundiert oder injiziert. Derzeit werden vor allem Adeno-assoziierte Viren (AAV) als Genfähren verwendet. Die AAV-Vektoren integrieren ihr Erbgut nicht in das Genom der menschlichen Zelle, sondern es verbleibt als sogenanntes Episom im Zellkern und wird während einer Zellteilung daher nicht vermehrt. AAV-Vektoren werden deshalb für das Einbringen von Genen in postmitotisches Gewebe eingesetzt, das sich nicht vermehrt, zum Beispiel Retina, Leber oder Muskel. Die Selektivität der Viren für bestimmte Gewebe wird durch modifizierte Virushüllen und gewebespezifische Promotoren verbessert (8).