Codon: Nukleotidtriplett, das für eine Aminosäure kodiert
Deletion: Mutation, bei der es zum Verlust von Nukleotiden oder DNA-Sequenzen kommt
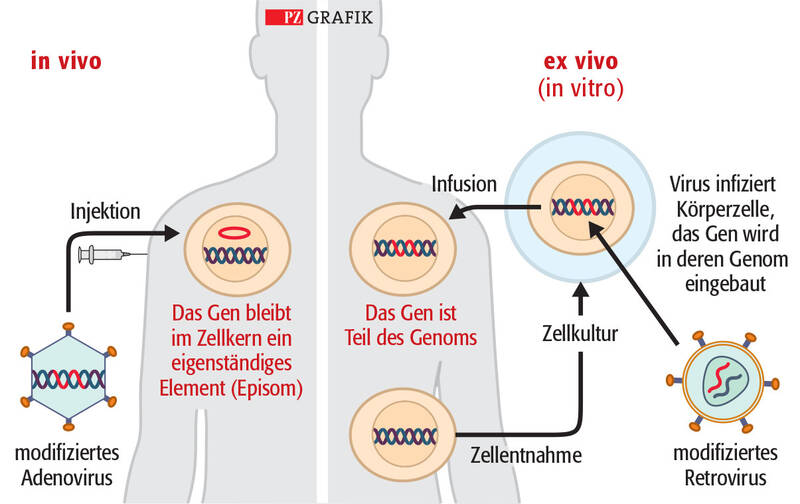
Episom: eigenständiges genetisches Element außerhalb des Genoms
Insertionsmutation: Einbau von zusätzlichen Nukleotiden oder DNA-Sequenzen in eine DNA-Sequenz. Eine Insertion führt zu einer Leserasterverschiebung, das Genprodukt, das auf dem Gen codiert ist, wird nicht mehr korrekt hergestellt.
Missense-Mutation: Punktmutation, bei der eine einzelne Nukleotidänderung zu einem Codon führt, das für eine andere Aminosäure kodiert
Promotor: Nukleotid-Sequenz der DNA, die die Expression eines Gens ermöglicht, indem sie an die RNA-Polymerase und weitere Proteine, sogenannte Transkriptionsfaktoren, bindet, die den Start des »Ablesens« des Gens durch die RNA-Polymerase vermitteln
Transduktion: Einbringen des genmodifizierten Materials mithilfe viraler Vektoren in eine Zielzelle
Transkription: Synthese von RNA durch Ablesen einer DNA
Translation: Synthese von Proteinen im Anschluss an die Transkription