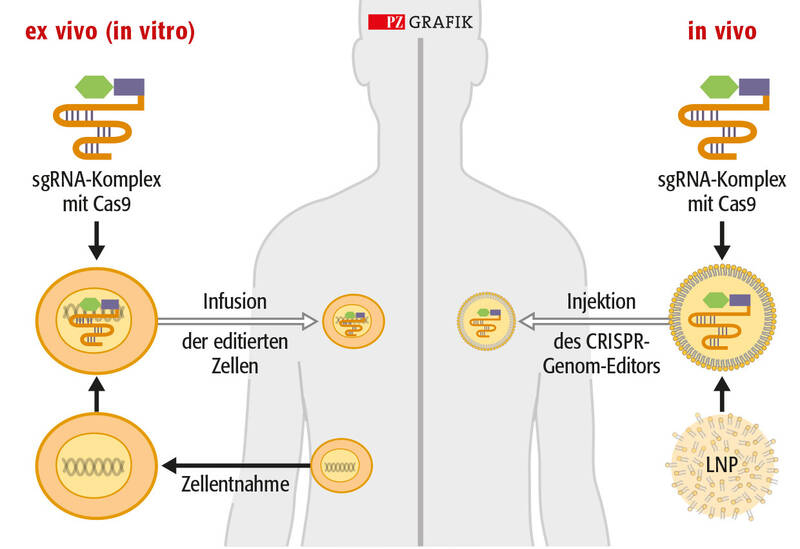
Ex-vivo-Therapie durch Genom-Editierung (links): Dabei werden Zellen von Patienten oder gesunden Spendern in einer kontrollierten Laborumgebung mit CRISPR bearbeitet. Die veränderten Zellen werden dann wieder in die Patienten eingebracht. In-vivo-Therapie durch Genom-Editierung (rechts): Hier werden CRISPR-Genom-Editoren direkt in Patienten eingebracht, wobei bestimmte Organe oder Gewebe gezielt angesteuert werden.
Der Transfer der CRISPR-Komponenten erfolgt entweder mit viralen Vektoren (meist Lentiviren und Adeno-assoziierte Viren), denen ihr natives Genom und ihre Replikationsfähigkeit fehlen (links), oder mit Lipid-Nanopartikeln (LNP, rechts). In die LNP sind entweder CRISPR/Cas-Ribonukleoproteine eingepackt, bei denen ein rekombinant hergestelltes Cas-Protein mit der spezifischen Leit-RNA (sgRNA) vorkomplexiert ist. Alternativ kann eine mRNA-codierte Cas-Nuklease zusammen mit der spezifischen Leit-RNA verpackt sein.
Grafik mod. nach DOI: 10.1016/j.cell.2024.01.042