Die entstandenen CAR-modifizierten Zellen werden einige Tage im Labor zu Millionen von CAR-T-Zellen expandiert, kryokonserviert und in speziellen Transportbehältnissen an das Behandlungszentrum zurücktransportiert. Nach sorgfältiger Qualitätskontrolle und Auftauen auf Station werden die individuell patientenspezifisch hergestellten CAR-T-Zellen dem Patienten reinfundiert. Die Dosis der infundierten Zellen variiert je nach Therapie zwischen 106 und 109 Zellen pro Dosis (siehe Fachinformationen).
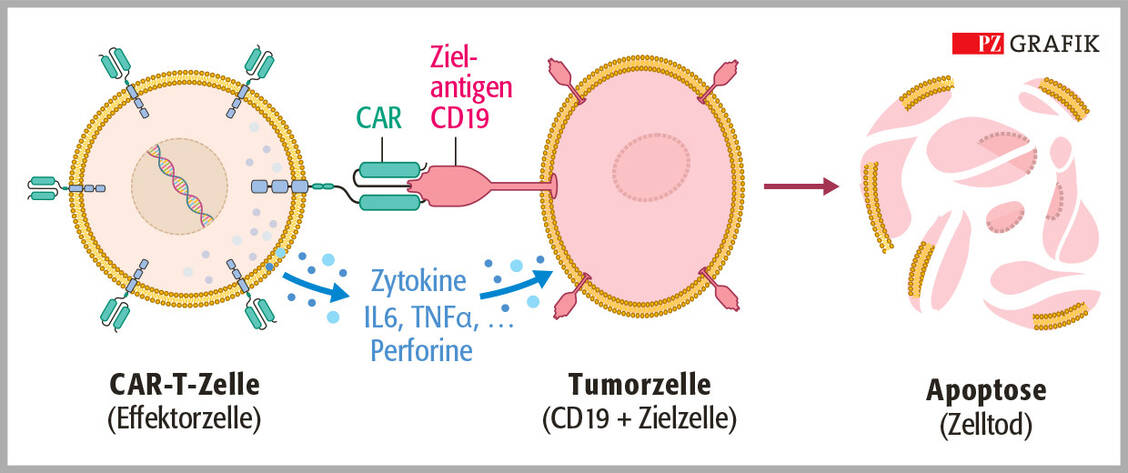
CAR-T-Zellen können Tumorzellen in Blut, Knochenmark und Lymphknoten gut erreichen, während dies bei soliden Tumoren erschwert ist. Durch Vermehrung der CAR-T-Zellen im Körper kommt es über die Zeit zu einer »Wirkstoff«-Erhöhung. Nach Verschwinden der Tumorzellen können die CAR-T-Zellen im Patienten persistieren und bei Rezidiven erneut aktiv werden.