|
Fertigarzneimittel, INN, Hersteller
|
EU-Zulassung zur Behandlung von
|
FDA-Zulassung
|
Zulassungsstudie (Referenz)
|
Response (in Prozent)
|
Toxizität Grad 3 und 4 (in Prozent)
|
|
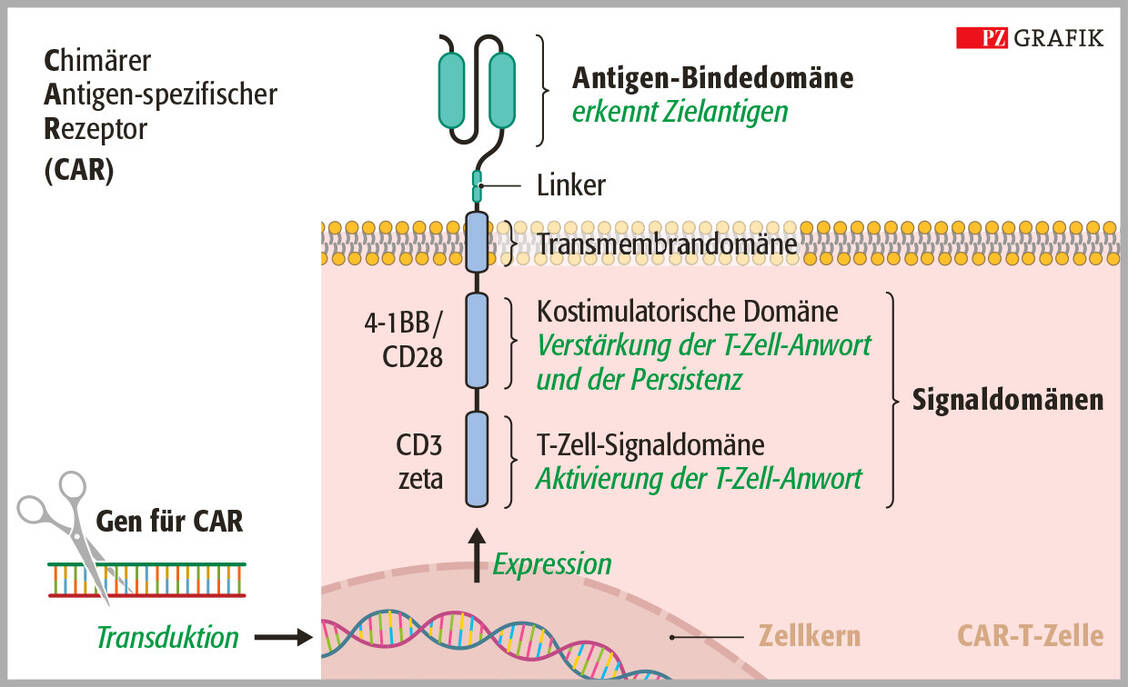
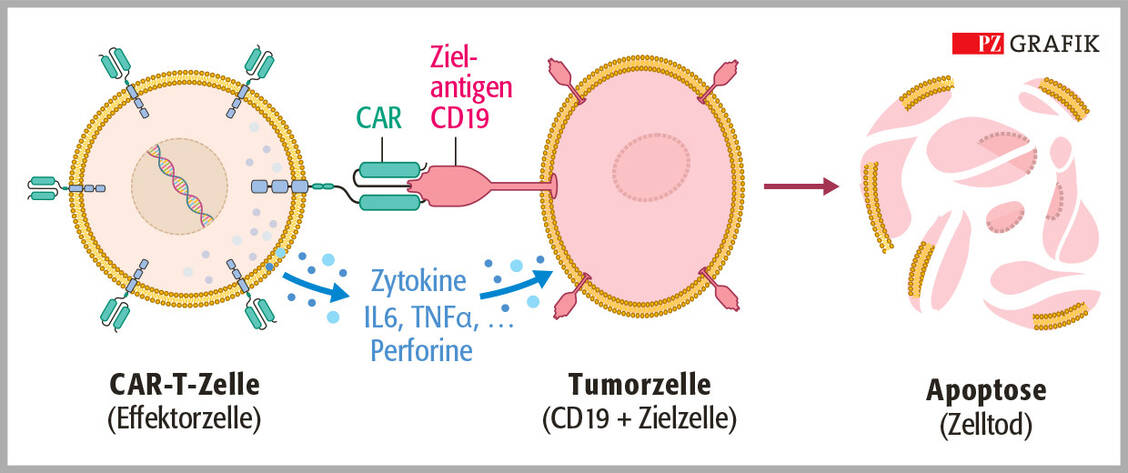
Zielantigen CD19 (Cluster of Differentiation 19, B-Lymphozyten-Oberflächenantigen)
|
|
|
|
|
|
|
Kymriah®,Tisagenlecleucel,Novartis
|
Kindern, Jugendlichen und jungen Erwachsenen im Alter bis zu 25 Jahren mit refraktärer oder rezidivierter akuter lymphatischer B-Zell-Leukämie (RR-B-ALL)
|
2017
|
ELIANA (4)(NCT02435849)
|
ORR (81),CR (60)
|
CRS (46), ICANS (13), Zytopenie (61)
|
|
Kymriah®,Tisagenlecleucel,Novartis
|
Erwachsenen mit rezidiviertem oder refraktärem diffus großzelligen B-Zell-Lymphom (RR-DLBCL)
|
2018
|
JULIET (5)(NCT02445248)
|
ORR (52),CR (40), PR (12)
|
CRS (22), ICANS (12), Zytopenie (32)
|
|
Kymriah®,Tisagenlecleucel,Novartis
|
Erwachsenen mit rezidiviertem oder refraktärem follikulären Lymphom (RR-FL)
|
2021
|
ELARA (6)(NCT03568461)
|
ORR (86),CR (69)
|
CRS (49), ICANS (28), Infektionen (5)
|
|
Yescarta®,Axicabtagen-Ciloleucel,Gilead
|
Erwachsenen mit rezidiviertem oder refraktärem diffus großzelligen B-Zell-Lymphom (RR-DLBCL) oder mit primär mediastinalem B-Zell-Lymphom (PMBCL)
|
2017
|
ZUMA-1 (8)(NCT02348216)
|
ORR (82),CR (54)
|
CRS (13), ICANS (31), Zytopenie (78)
|
|
Tecartus®,Brexucabtagen-Autoleucel,Gilead
|
Erwachsenen mit rezidiviertem oder refraktärem Mantelzell-Lymphom (RR-MCL) mit mindestens zwei vorangegangenen Therapien unter Einschluss eines Tyrosinkinase-(BTK-)Inhibitors
|
2020
|
ZUMA-2 (9)(NCT02601313)
|
ORR (85),CR (59)
|
CRS (15), ICANS (31), Zytopenie (94), Infektionen (32)
|
|
Breyanzi®,Lisocabtagen maraleucel,Bristol Myers Squibb
|
Erwachsenen mit rezidiviertem oder refraktärem diffus großzelligen B-Zell-Lymphom (RR-DLBCL), primär mediastinalem großzelligen B-Zell-Lymphom (PMBCL) und follikulärem Lymphom Grad 3B (FL3B)
|
2021
|
TRANSCEND (10)(NCT02631044)
|
ORR (73),CR (53)
|
CRS (2), ICANS (10), Zytopenie (60)
|
|
Zielantigen BCMA (B-Zell-Reifungs-Antigen)
|
|
|
|
|
|
|
Abecma®,Idecabtagen vicleucel (Ide-Cel),Bristol Myers Squibb
|
Erwachsenen mit rezidiviertem oder refraktärem Multiplen Myelom (RR-MM) mit mindestens drei vorherigen Behandlungen, darunter ein Immunmodulator (IM), ein Proteasom-Inhibitor (PI) und ein Anti-CD38-Antikörper (CD38-AK)
|
2021
|
KarMMa (11)(NCT03361748)
|
ORR (73),CR (33)
|
CRS (5), ICANS (3), Zytopenie (89)
|
|
Carvykti®,Ciltacabtagen autoleucel, (Cilta-cel),Janssen
|
bedingte Zulassung: Erwachsene mit rezidiviertem und refraktärem Multiplen Myelom (RR-MM) mit mindestens drei vorherigen Behandlungen, darunter ein IM, PI und CD38-AK
|
2022 (EU)
|
CARTITUDE (12)(NCT03548207)
|
ORR (97),CR (67)
|
CRS (4), ICANS (9), Zytopenie (95)
|