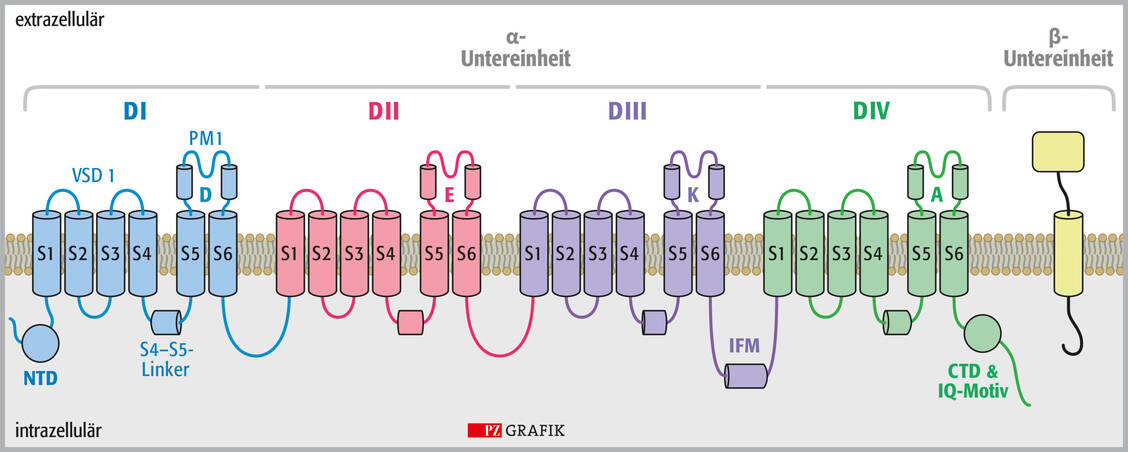
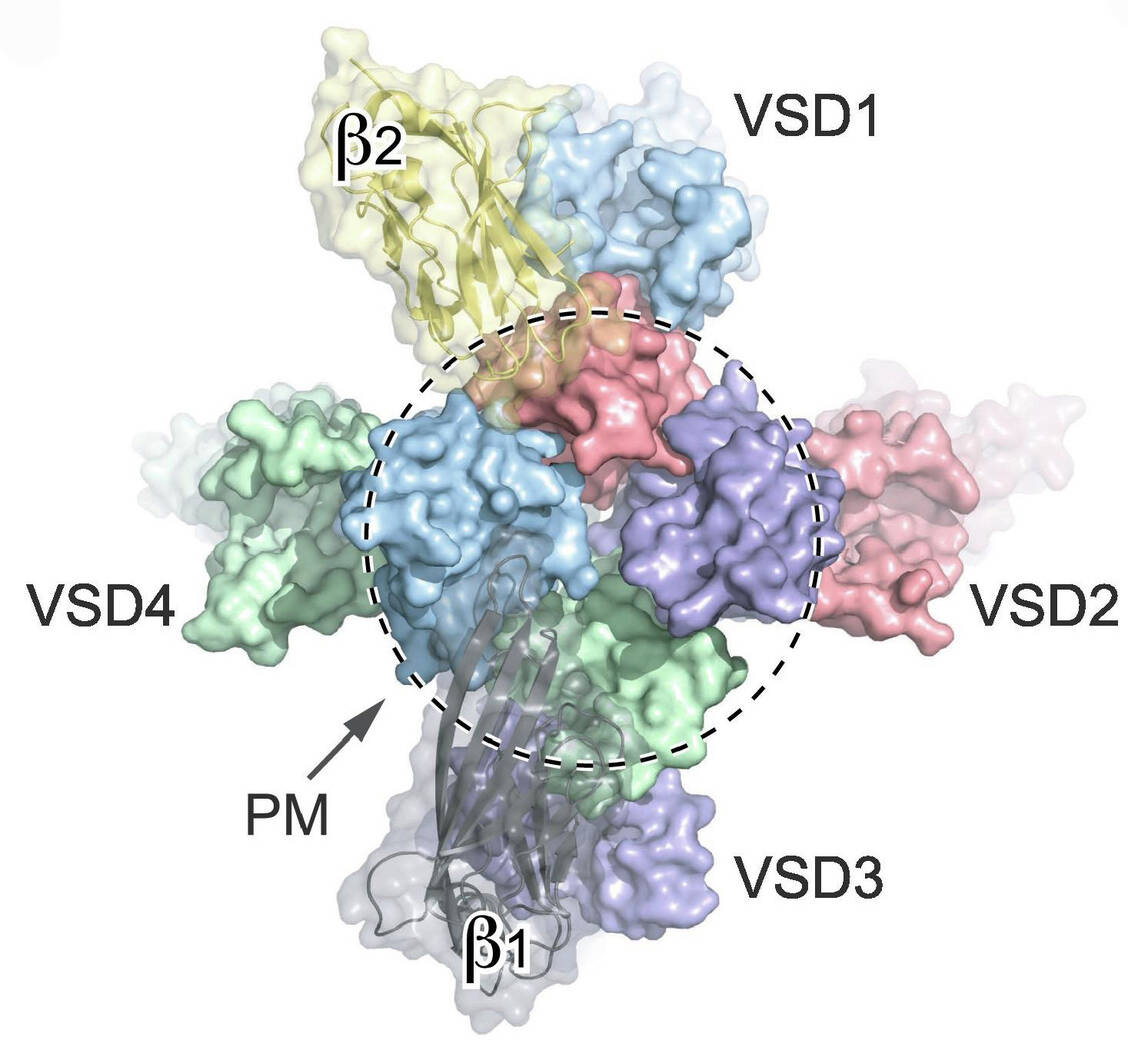
Prinzipiell bestehen die komplex aufgebauten, aus etwa 2000 Aminosäuren bestehenden Natriumkanäle aus einer α-Einheit, die aus vier miteinander verbundenen, nicht identischen, aber homologen Domänen (DI bis DIV) besteht. Jede Domäne besteht wiederum aus sechs miteinander verbundenen transmembranären Segmenten (S1 bis S6), wobei S1 bis S4 spannungsempfindliche Module (voltage-sensing domains VSD1 bis VSD4) sind und S5 und S6 eine zentrale Pore bilden (Porenmodul PM) (1). Dabei sind S4 und S5 über einen Linker miteinander verbunden. Die Abbildung 1 zeigt den komplizierten Aufbau anschaulich. S5 und S6 sind über einen extrazellulären Haarnadel-Loop miteinander verbunden, der den Ionenkanälen den Namen P-Loop-Kanäle gegeben hat.