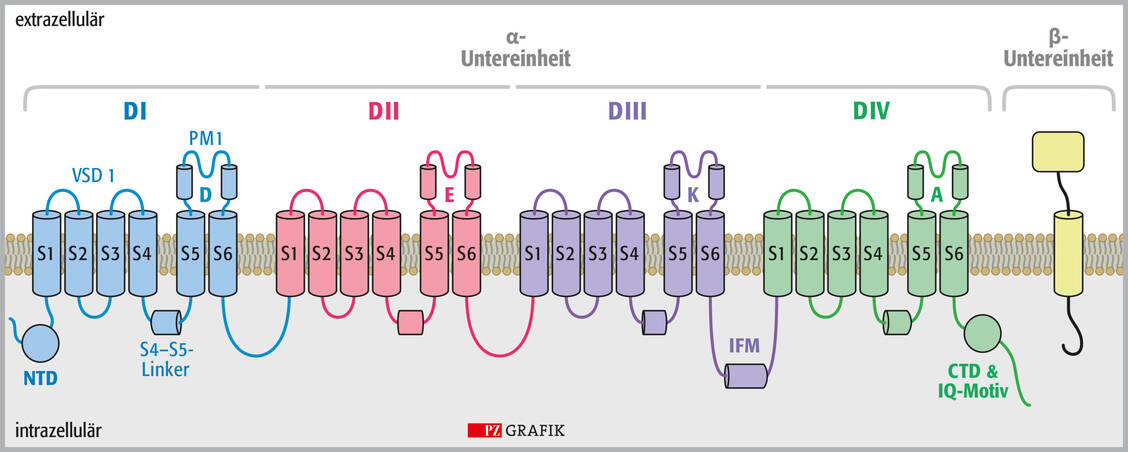
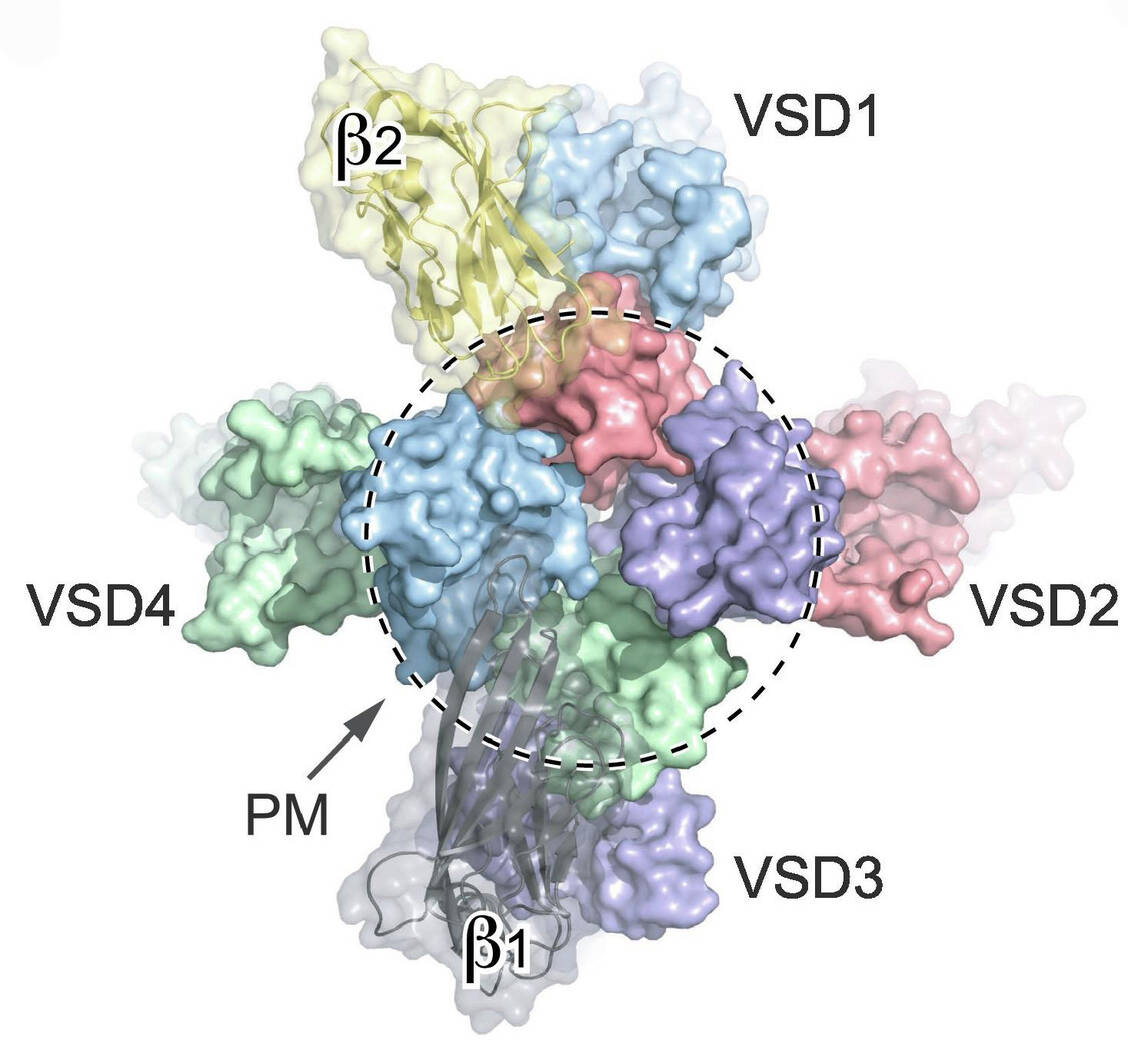
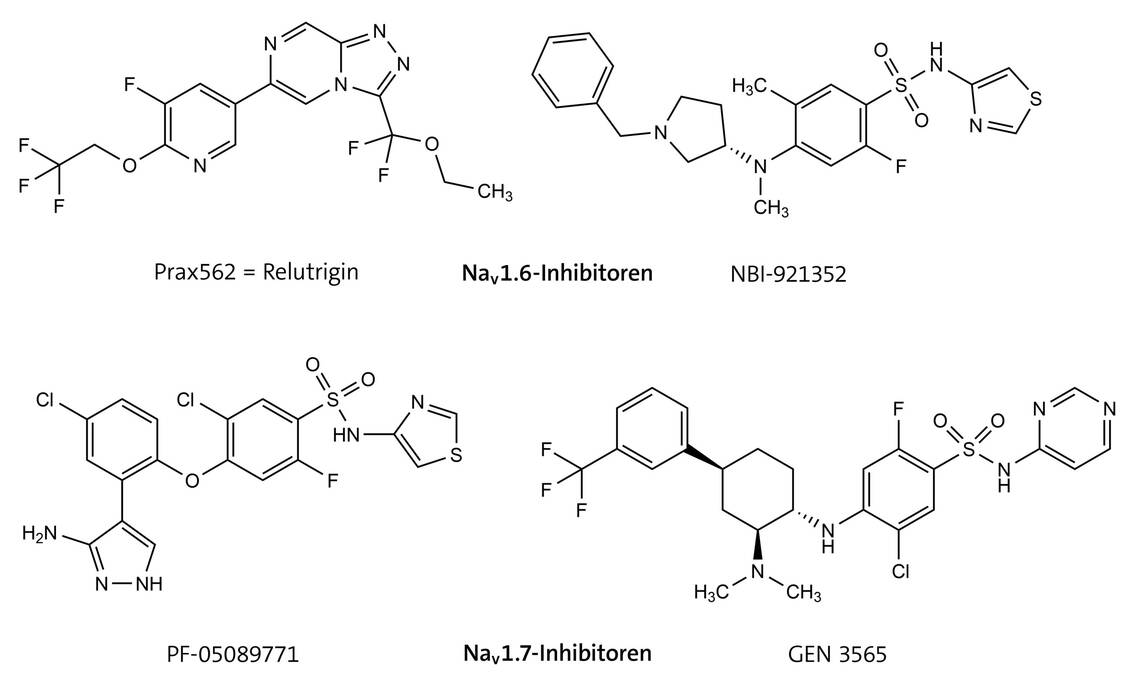
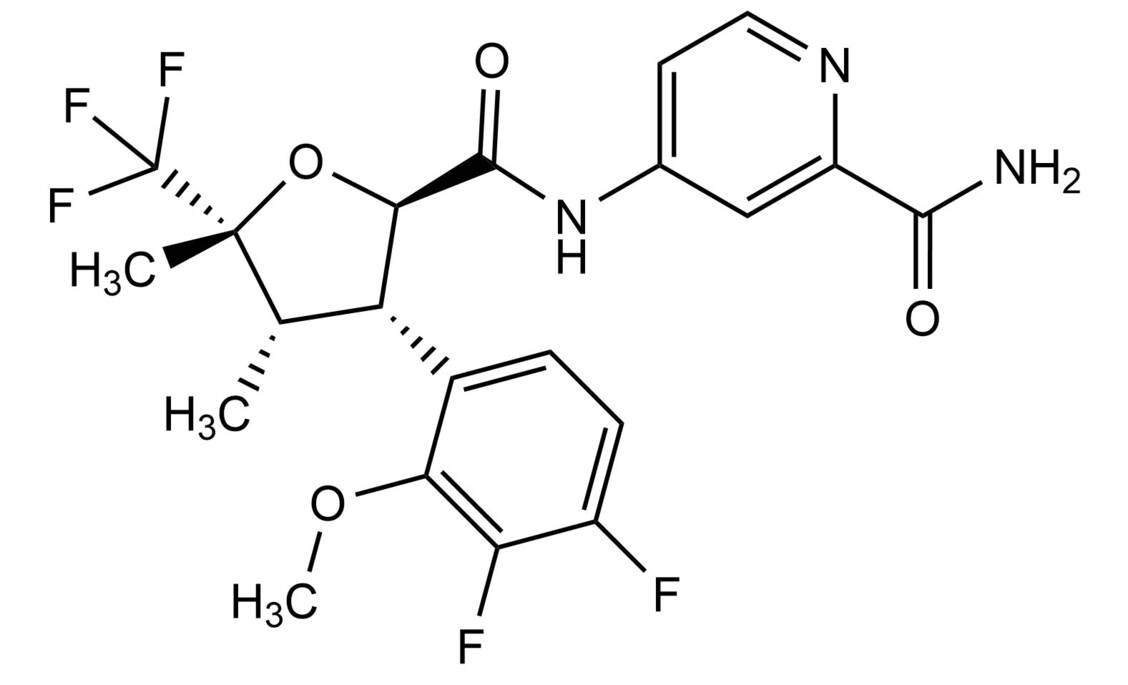
Antiarrhythmika der Klasse 1 beeinflussen den Natriumeinstrom am Nav1.5-Kanal und werden bei der Behandlung des langen QT-Syndroms (LQT) eingesetzt (verlängerte QT-Zeit). Es gibt verschiedene LQT-Varianten. Beispielsweise destabilisiert LQT3 die schnelle Inaktivierung des Kanals, was zu einem persistierenden Na⁺-Einwärtsstrom führt und damit zu einer verspäteten Repolarisation.
LQT-Syndrome werden häufig mit Betablockern behandelt, wobei der Erfolg nicht garantiert ist. Die Blockade der Natriumkanäle scheint effektiver zu sein. Mexiletin, ein Klasse-1b-Antiarrhythmikum, hat eine hohe Affinität zu überaktiven Nav1.5 und bewirkt eine Use-dependent-Blockade. Flecainid, ein Klasse-1c-Antiarrhythmikum, blockiert den Kanal im offenen Zustand. Ranolazin, ebenfalls ein Klasse-1c-Antiarrhythmikum, hat eine hohe Affinität zum persistierenden Natriumeinstrom in den Arterien.