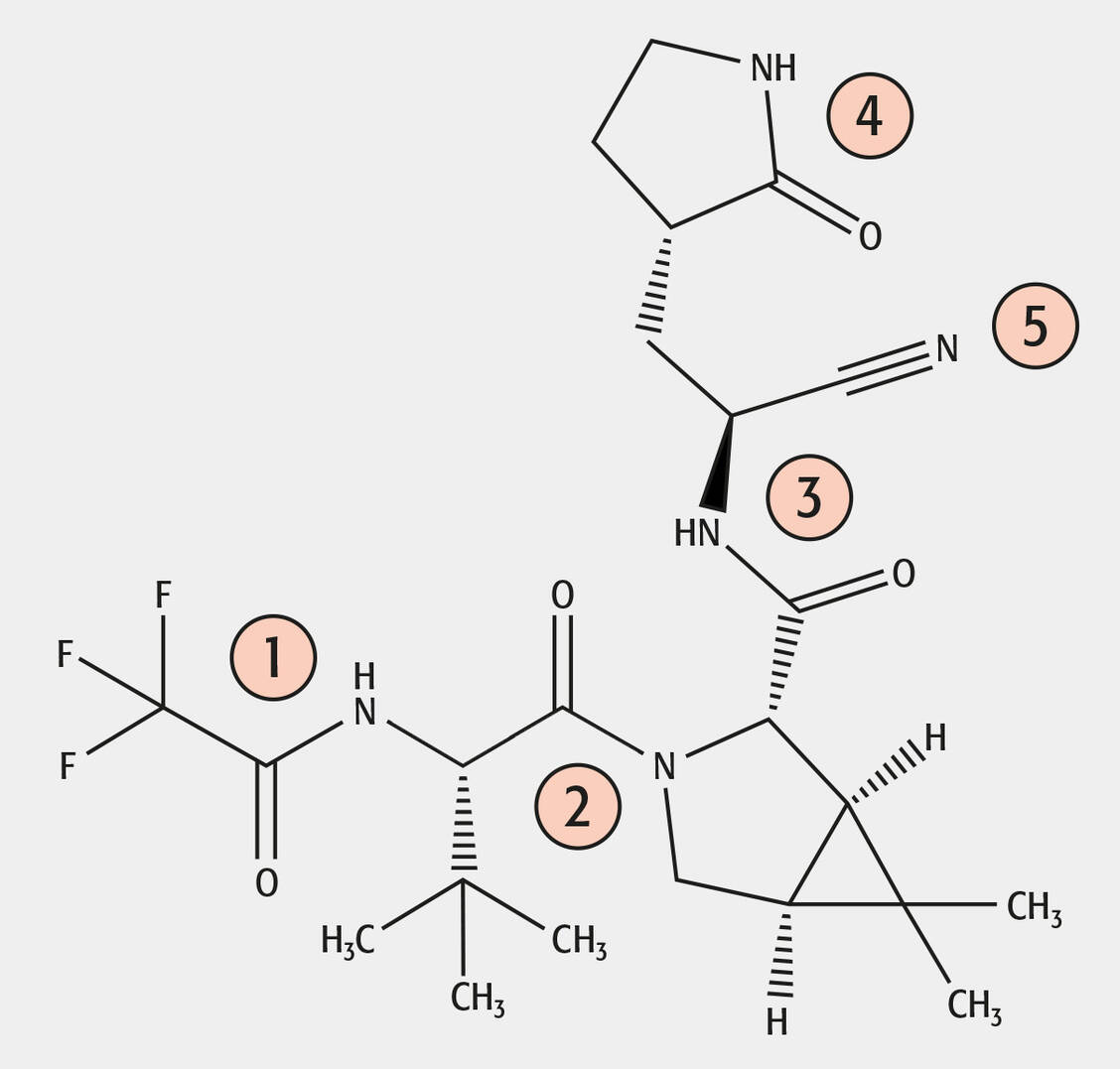
Zu Nirmatrelvir sind verständlicherweise bisher nur wenige Stabilitätsstudien bekannt. Das Molekül hat vier Amidfunktionen (Nr. 1–4 im Molekül) und eine Nitrilgruppe (Nr. 5), die hydrolytisch sowohl alkalisch als auch sauer gespalten werden können. Bemerkenswerterweise wird unter basischen Stressbedingungen nur das Nitril (Nr. 5) zu einem Amid hydrolysiert und am Amid 1 wird die Trifluoressigsäure abgespalten (Abbildung), wobei hier das entsprechende Amin entsteht (17, 18). Außerdem wurde eine Epimerisierung in Nachbarschaft zum Nitril (Nr. 5) beobachtet (19).
In Stressstudien mit Licht, Oxidation und Hitze erwies sich Nirmatrelvir als stabil (17, 20, 21). Bei jeweils zweistündiger Exposition von 1 M NaOH, 1 M HCl, 3 Prozent H₂O₂, Sonnenlicht und 80 °C wurde in einer neuen Studie nur im Alkalischen eine Zersetzung von knapp 30 Prozent beobachtet; alle anderen gefundenen Gehalte lagen über 96,6 Prozent (22).