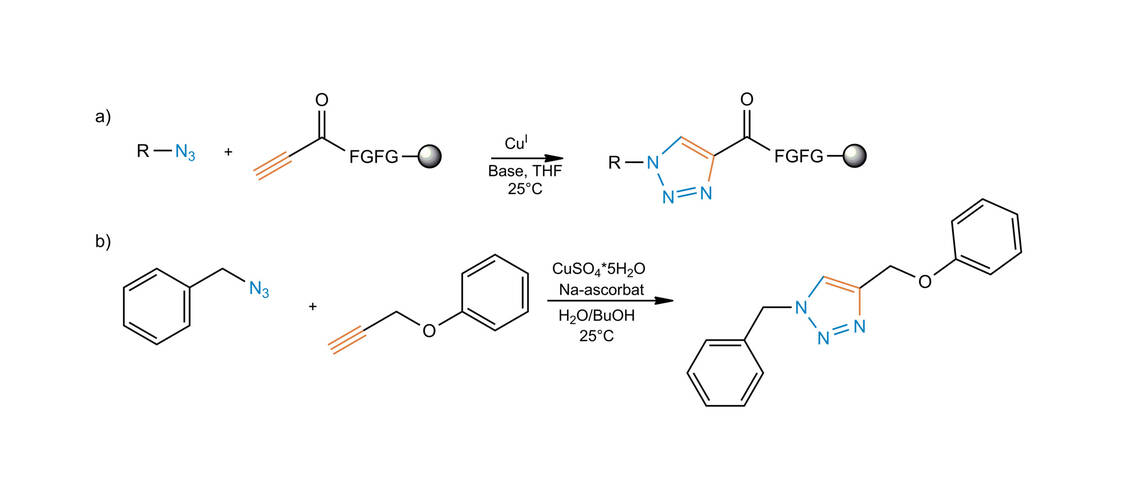
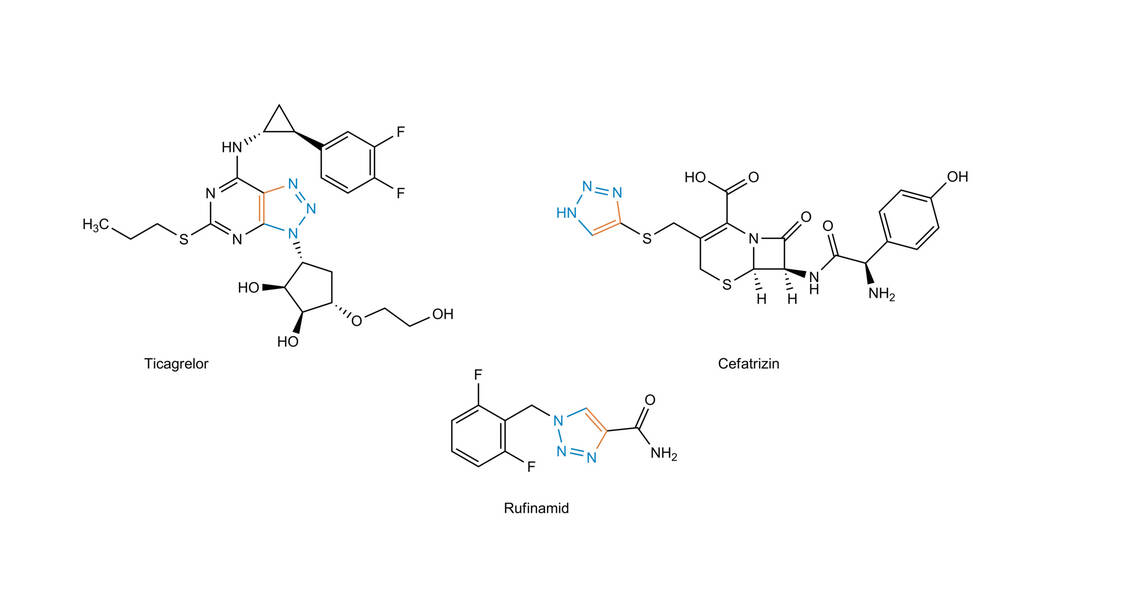
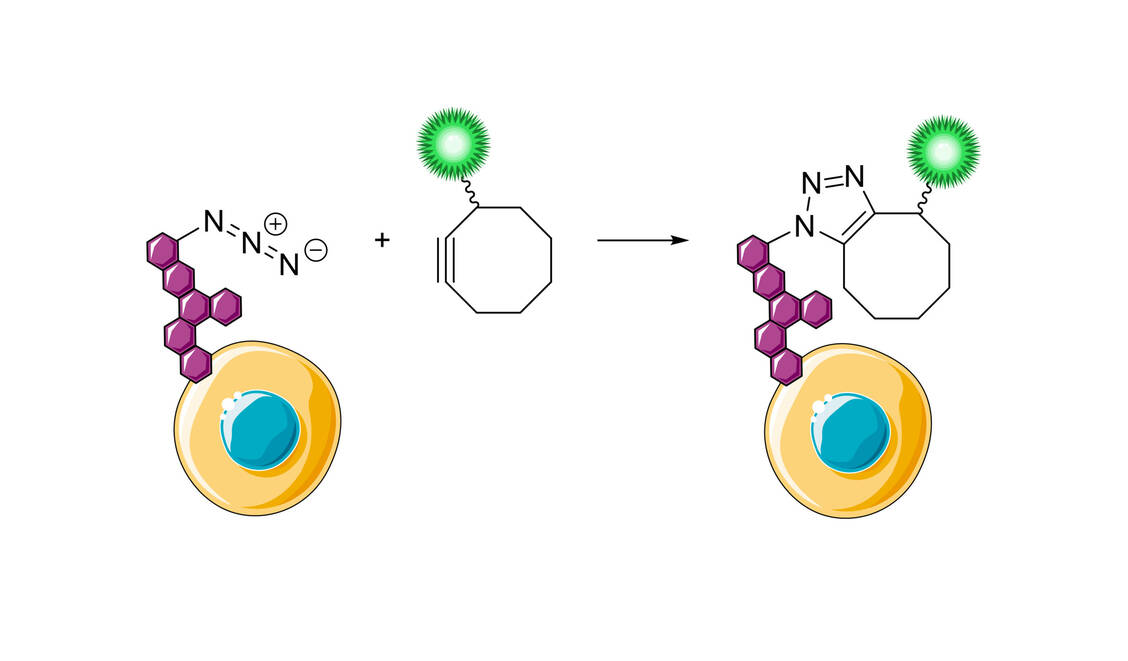
Dem Beispiel der Natur folgend, war Sharpless bestrebt, Moleküle durch Zusammenfügen kleinerer Einheiten über Heteroatombindungen (C-X-C) zu bilden. Das Ziel ist der Einsatz von leistungsfähigen und selektiven modularen »Baueinheiten«, die bei Synthesen mit hoher Zuverlässigkeit verwendbar sind. Diese Herangehensweise wurde von Sharpless »Click-Chemie« genannt, wobei strenge Kriterien definiert wurden, die eine chemische Reaktion erfüllen muss, um Anwendung zu finden. Unter anderem werden eine breite Anwendbarkeit, einfache Reaktionsbedingungen, hohe Ausbeuten, keine störenden Nebenprodukte, Stereospezifität und einfache Reinigung gefordert. Es ist wichtig zu verstehen, dass Click-Reaktionen die benötigten Charakteristika aus starken thermodynamischen Triebkräften beziehen. Derartige Reaktionen verlaufen schnell bis zum vollständigen Umsatz und haben die Tendenz, selektiv nur ein Produkt zu liefern. Als typische Reaktionen für die Click-Chemie werden folgende Reaktionen vorgeschlagen: