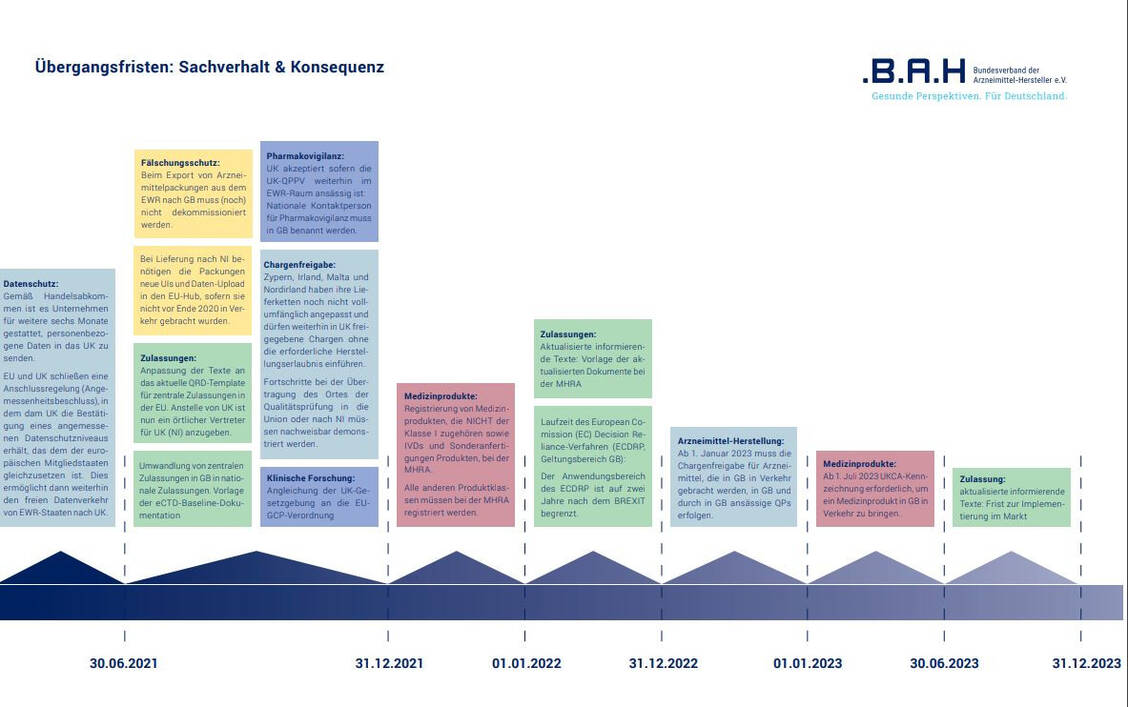
Der Brexit hat insbesondere regulatorische Folgen für die Arzneimittelindustrie. Daher muss es künftig ein Mutual Recognition Agreement (MRA) geben. Darauf pocht BAH-Hauptgeschäftsführer Hubertus Cranz anlässlich der Veröffentlichung der neuen Verbandsbroschüre, die sich mit diesem Themenkomplex auseinandersetzt. Darin geht es dem BAH vor allem um die Bereiche klinische Prüfung, Zulassung, Arzneimittelherstellung und -prüfung, Import und Export sowie Pharmakovigilanz. Weitere Inhalte sind Fälschungs-, Patent-, Marken- und Datenschutz sowie Regelungen rund um die Medizinprodukte. In den Augen des BAH muss es bald dringend Vereinbarungen zur gegenseitigen Anerkennung von Chargen- und Importtests, amtlichen Arzneimittel-Kontroll-Laboren, GMP-Inspektionen sowie CE-Kennzeichnungen von Medizinprodukten geben.