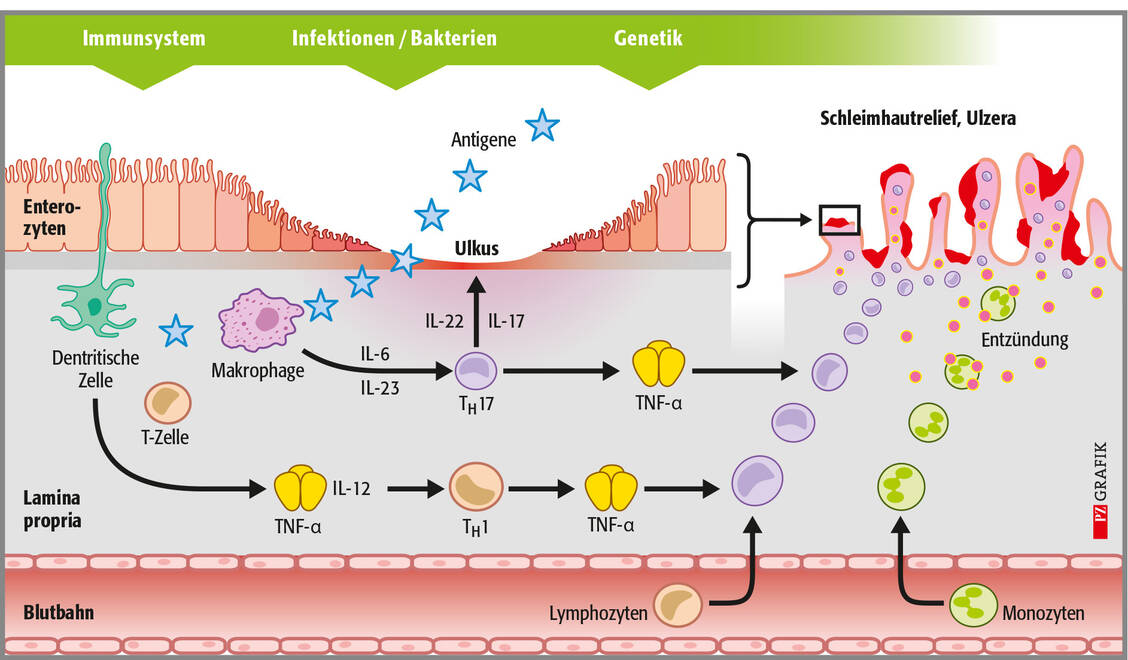
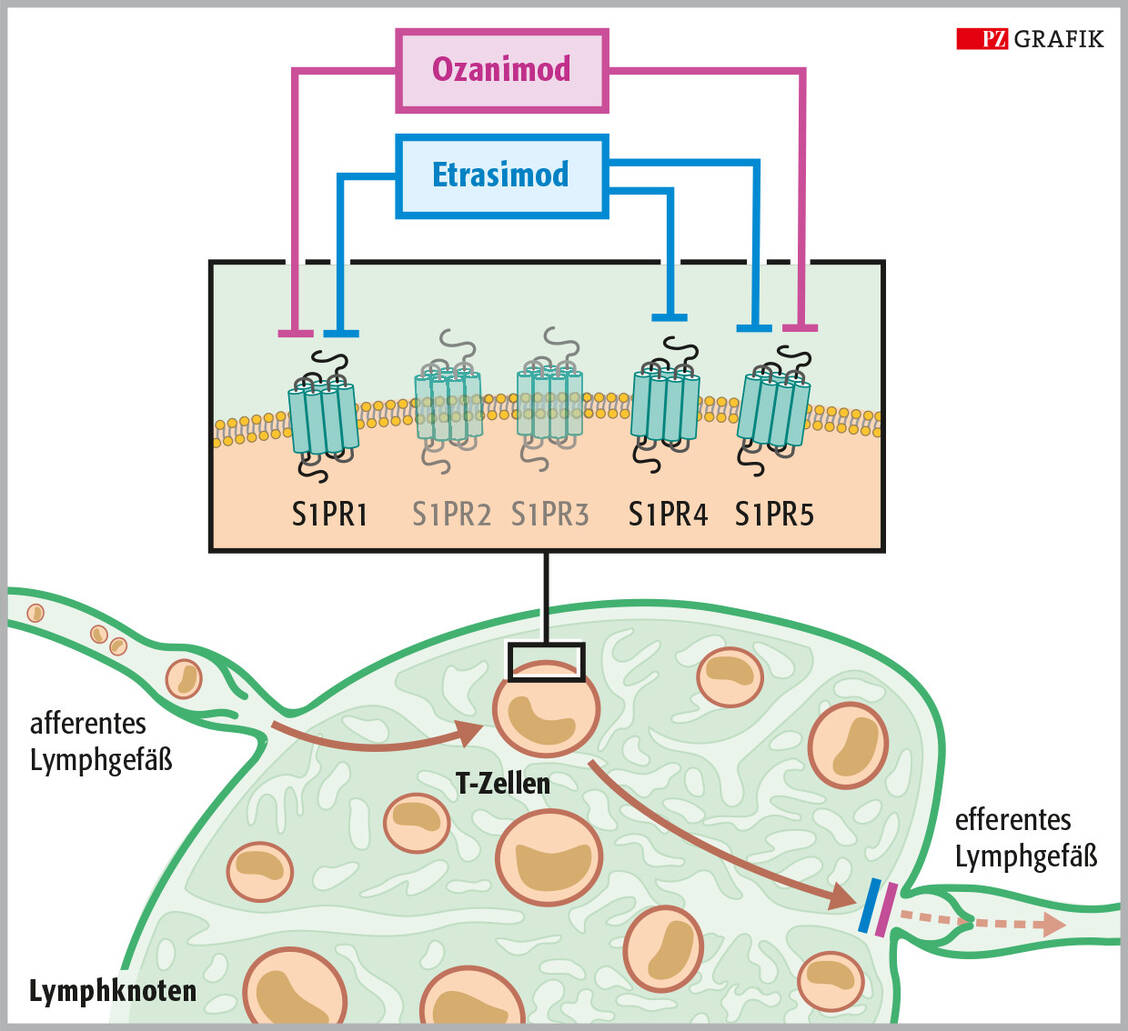
Die pharmazeutische Beratung von Patienten mit CED in der Apotheke hat vielfältige Facetten. Dazu gehören die Klärung potenzieller pharmakokinetischer Interaktionen bei oralen Therapeutika (Jakinibe, S1PR-Modulatoren) und die Bewertung von Nebenwirkungen durch Immunsuppression (Infektanfälligkeit, Impfstrategie).
Schmerzen sind eine sehr häufige Begleiterscheinung der CED, besonders als erstes Symptom, aber auch außerhalb eines Schubs. Oftmals reicht die Behandlung der Grunderkrankung zur Schmerzbekämpfung nicht aus, sodass eine symptomatische Analgesie unerlässlich ist. Wichtig: Die klassischen NSAID sind aufgrund ihres Risikopotenzials für gastrointestinale Schädigungen nicht indiziert; sie werden sogar als schubauslösend bei CED-Patienten beschrieben. Das gilt natürlich für jegliche Schmerztherapie, also auch bei Kopf-, Bauch- oder Rückenschmerzen.
Das Apothekenteam sollte die Patienten zur moderaten Anwendung von Paracetamol oder Metamizol oder zur temporären Gabe von Opioid-Analgetika beraten und an den Arzt verweisen.