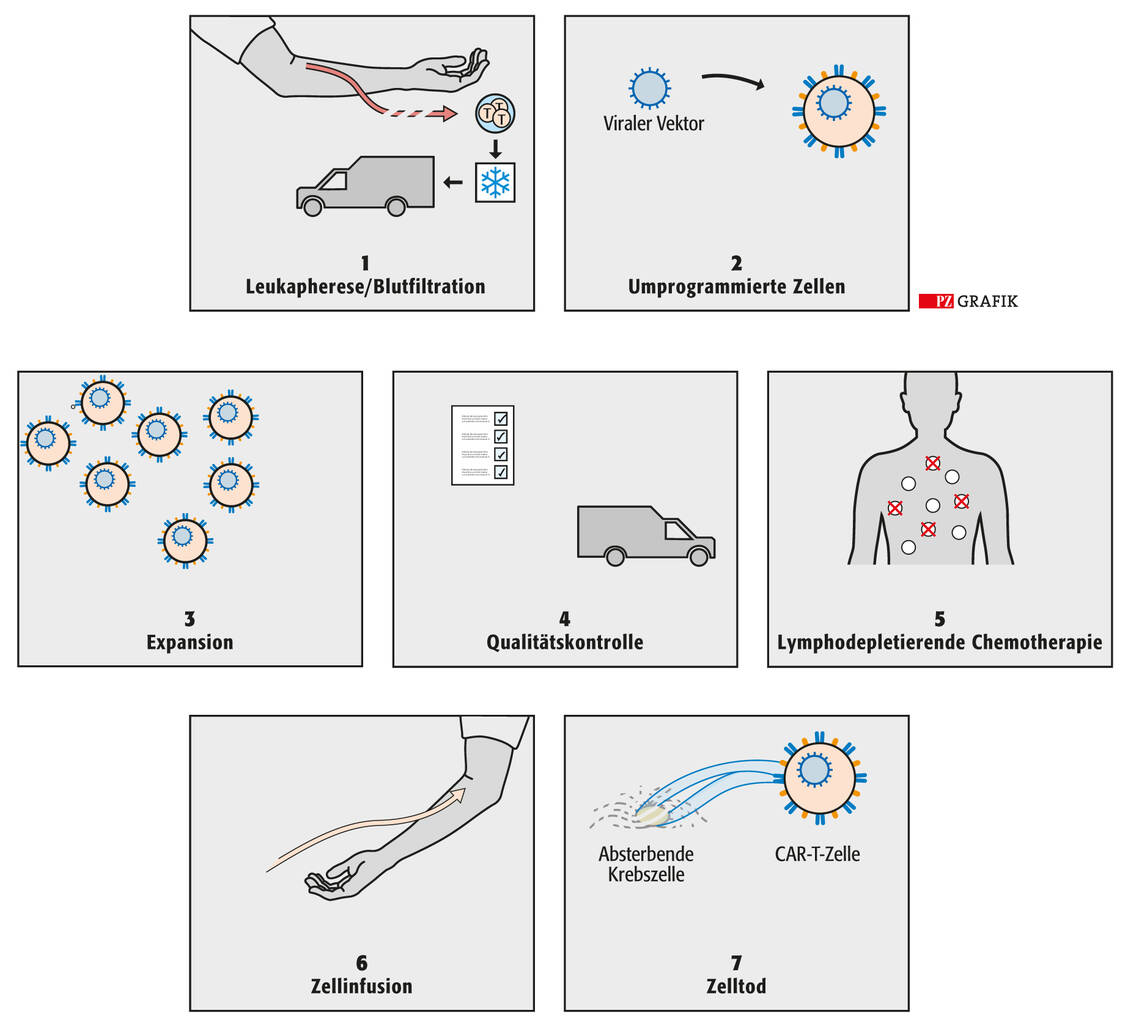
Eine CAR-T-Zelltherapie darf nur in einer qualifizierten klinischen Einrichtung erfolgen und muss von speziell geschultem Personal durchgeführt werden. Vor der Infusion muss sichergestellt sein, dass eine Notfallausrüstung sowie mindestens vier Dosen des Anti-Interleukin-6-Antikörpers Tocilizumab (RoActemra®) vorhanden sind. Der Grund für diese Vorsichtsmaßnahme ist das mögliche Auftreten eines sogenannten Zytokin-Freisetzungssyndroms. Dabei handelt es sich um eine massive Freisetzung von Zytokinen aus T-Zellen, die unter anderem zu Blutdruckabfall, Gehirnödem, Schock und Herzstillstand führen kann. Tocilizumab dämpft diese überschießende Immunantwort. In der Fachinformation von Yescarta wird dazu geraten, dass die Patienten nach der Behandlung zehn Tage lang engmaschig mit Blick auf Nebenwirkungen überwacht werden. Zudem sollten sie sich nach der Infusion mindestens vier Wochen lang in der Nähe einer Fachklinik aufhalten.