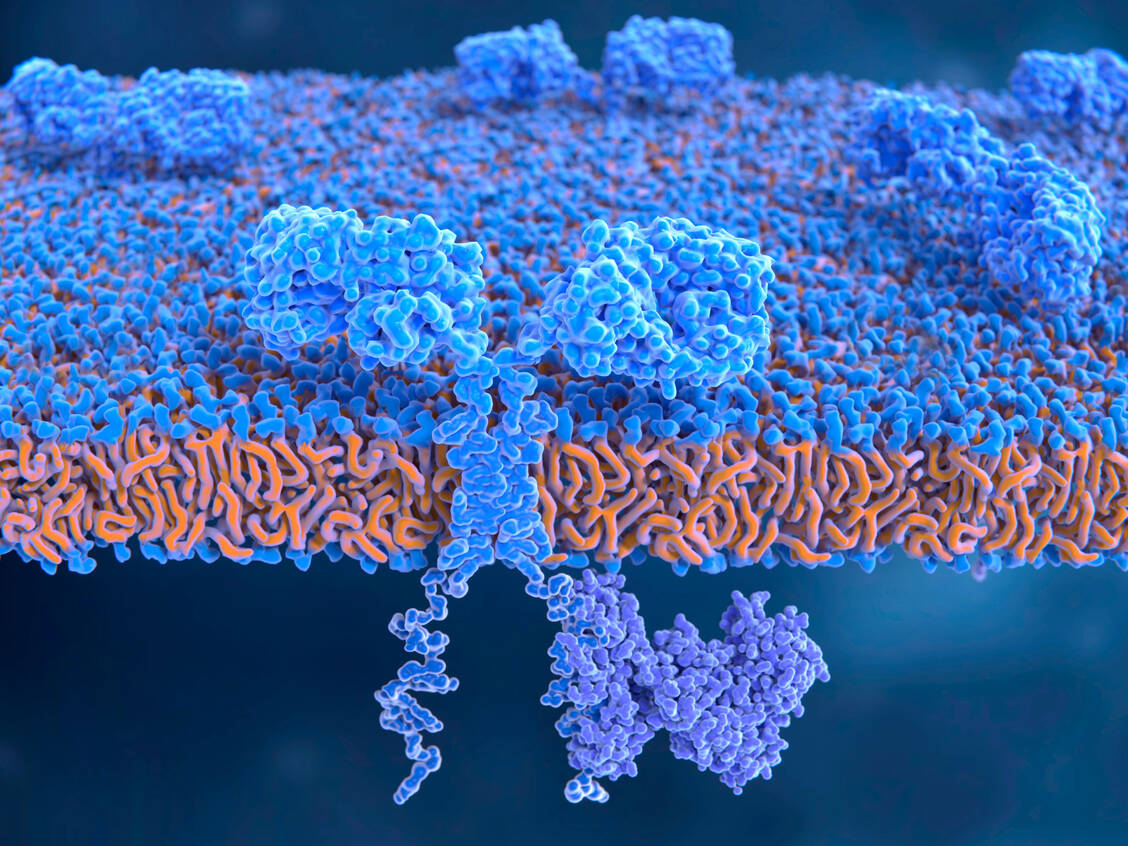
Die CAR-T-Zelltherapie ist en vogue. Sie vereint Immun-, Gen- und Zelltherapie. In nicht einmal fünf Jahren kamen sechs verschiedene CAR-T-Zelltherapeutika auf den deutschen Markt. Teilweise ähneln sich die Präparate, weshalb heutzutage CAR-T-Zelltherapeutikum nicht automatisch auch Sprunginnovation bedeutet. Bestes Beispiel dafür ist der Neuling Ciltacabtagen Autoleucel (Carvykti®). Es unterscheidet sich vom bereits 2022 eingeführten Idecabtagen Vicleucel (Abecma®) kaum. Beide CAR-T-Zelltherapeutika haben das B-Zell-Reifungsantigen (BCMA) als Zielantigen, beide kommen ab der Viertlinie beim Multiplen Myelom zum Einsatz. Das zugelassene Anwendungsgebiet ist gleich.
Natürlich sind neue Therapieoptionen beim noch immer nicht heilbaren Multiplen Myelom gern gesehen und auch auf die neue Therapie sprachen viele der bereits stark vorbehandelten Patienten an. Dennoch kann man vorläufig nur die Einstufung als Analogpräparat vornehmen. Ein direkter Vergleich mit Abecma und/oder dem Antikörper-Wirkstoff-Konjugat Belantamab-Mafodotin (Blenrep®), eine weitere BCMA-spezifische Therapie beim Multiplen Myelom, wäre sehr wünschenswert.
Sven Siebenand, Chefredakteur