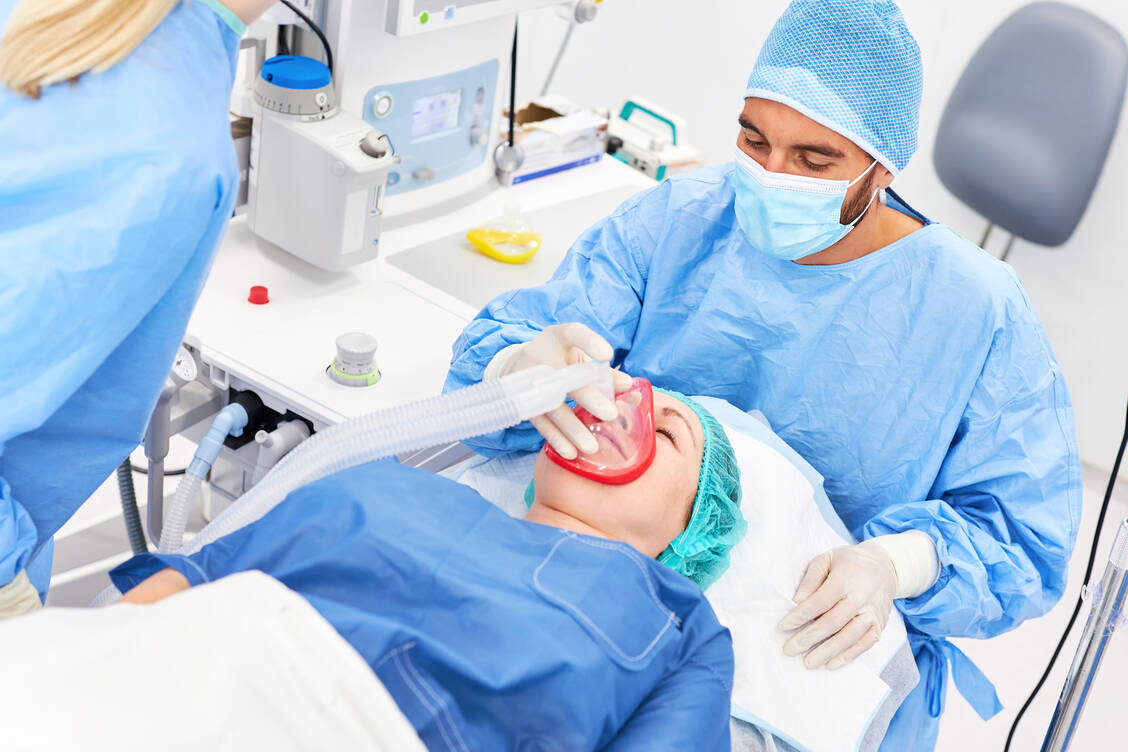
Bei dem 68-jährigen Herrn P. wurde aufgrund langjähriger Schmerzen bei Hüftgelenksarthrose die Indikation für einen Hüftgelenksersatz gestellt. Eine ebenfalls lang bestehende, aber gut eingestellte rheumatoide Arthritis sowie eine Hypertonie gehören zu seinen Grunderkrankungen. Vier Tage vor dem geplanten Eingriff ist er zur Vorbesprechung angemeldet und soll seinen Medikationsplan mitbringen.
Beim Termin in der Prämedikationssprechstunde erfolgen eine Routineblutabnahme, ein MRSA-Nasenabstrich sowie ein Covid-Abstrich. Außerdem hat Herr P. ein Aufnahmegespräch mit einer Apothekerin sowie mit der Anästhesistin und einem Chirurgen. Da sein Hausarzt einen bundeseinheitlichen Medikationsplan erstellt hat, kann die Apothekerin diesen per QR-Code-Scan in die elektronische Verordnung überführen. Sie erfragt weitere im Plan nicht erfasste OTC-Medikamente und ergänzt den Applikationstag von Etanercept, da die Medikation mit »alle sieben Tage« angegeben ist. Zusätzlich zum TNFα-Blocker Etanercept bekommt Herr P. niedrig dosiertes Prednisolon 4 mg/Tag und Ramipril 5 mg einmal täglich. Am Morgen des Vorgesprächs hat er Etanercept gespritzt. Aus der aktuellen Medikation des Patienten ergeben sich keine relevanten Wechselwirkungen; ein Abgleich mit der aktuellen Nierenfunktion zeigt keinen Handlungsbedarf.
Beim Gespräch mit dem Anästhesisten ergibt sich jedoch eine Unsicherheit bezüglich einer möglichen Pausierung der antirheumatischen Medikation. Die Apothekerin hat aber bereits hinterlegt, dass das niedrig dosierte Glucocorticoid und auch Etanercept weitergeführt werden können. Obwohl Rheumapatienten ein erhöhtes postoperatives Infektionsrisiko haben, ist gemäß den aktuellen Empfehlungen der Fachgesellschaften eine Pause bei gut eingestellter Grunderkrankung und niedrig dosiertem Glucocorticoid nicht grundsätzlich notwendig. Da der Eingriff einige Tage nach Verabreichung der wöchentlichen Etanercept-Dosis erfolgt, ist der empfohlene Abstand zur Operation von einer Halbwertszeit (etwa 70 h) gegeben. Am nächsten geplanten Applikationstag nach der OP kann die Therapie bei unauffälligen Wundverhältnissen weitergeführt werden, damit kein Risiko für einen Rheumaschub entsteht.
Da das perioperative Pausieren von Antirheumatika eine individuelle Nutzen-Risiko-Bewertung erfordert, hat sich die Apothekerin zusätzlich beim behandelnden Rheumatologen zum vorgeschlagenen Prozedere rückversichert. Ihr schriftlicher Vermerk zum perioperativen Umgang mit der Medikation ist in der elektronischen Patientenakte hinterlegt und für alle Beteiligten einsehbar.