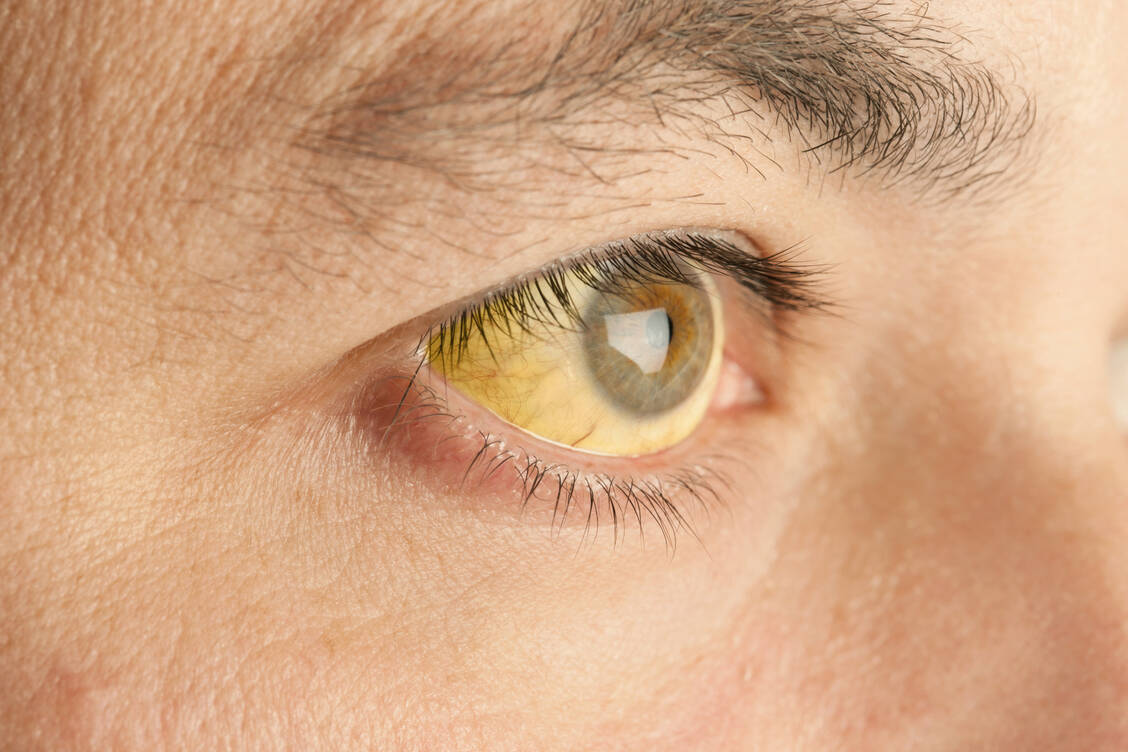
Eine 60-jährige Patientin wurde neu mit der Erstdiagnose einer dekompensierten Leberzirrhose aufgenommen. Sie erhält vom Heilpraktiker als Nahrungsergänzungsmittel Vitamin-B-Komplex, Papaya-Kapseln und ein Komplexpräparat mit Biotin, Chrompicolinat und Garcinia cambogia. Kann sie diese weiter einnehmen?
B-Vitamine in normalen Dosierungen, die der empfohlenen Zufuhr pro Tag entsprechen, sind unbedenklich. Die genaue Zusammensetzung des verwendeten Präparats sollte daraufhin überprüft werden. Für Papaya-Kapseln finden sich keine Hinweise auf hepatotoxische Effekte. Berichtet sind gastrointestinale Reizungen. Da bei einer schweren Leberzirrhose gastrointestinale Ulcera häufig sind, sollte die weitere Einnahme kritisch hinterfragt werden. Chrompicolinat in höheren Dosen und über mehrere Monate kann zu transienten Leberschäden führen, sehr hohe Dosen auch zum Leberversagen. Für Garcinia cambogia liegen Berichte über arzneimittelinduzierte Leberschädigung vor, wenn es als Bestandteil von Nahrungsergänzungsmitteln eingenommen wurde.
Von der weiteren Einnahme des Komplexpräparats ist dringend abzuraten. Eventuell muss das Präparat als Auslöser der neu aufgetretenen Leberzirrhose in Betracht gezogen werden. Dann sollte eine Meldung als unerwünschte Arzneimittelwirkung erfolgen.