Dingermann, T., Winckler, T., Zündorf, I., Gentechnik – Biotechnik. 3. Aufl., Wiss. Verlagsges. Stuttgart 2019.
Ingram, G. I., The history of haemophilia. J. Clin. Pathol. 29 (1976) 469-479.
Mannucci, P. M., Hemophilia therapy: the future has begun. Haematologica 105 (2020) 545-553.
Peters, R., Harris, T., Advances and innovations in haemophilia treatment. Nat. Rev. Drug Discov. 17 (2018) 493-508.
Key, N. S., Inhibitors in congenital coagulation disorders. Br. J. Haematol. 127 (2004) 379-391.
Giangrande, P., Haemophilia B: Christmas disease. Expert Opin Pharmacother. 6 (2005) 1517-1524.
Liu, J., et al., Improved expression of recombinant human factor IX by co-expression of GGCX, VKOR and furin. Protein J. 33 (2014) 174-183.
Blair, H. A., Emicizumab: A Review in Haemophilia A. Drugs. 79 (2019) 1697-1707.
Lenting, P. J., et al., Emicizumab, a bispecific antibody recognizing coagulation factors IX and X: how does it actually compare to factor VIII? Blood 130 (2017) 2463-2468.
Spadarella, G., et al., Paradigm shift for the treatment of hereditary haemophilia: Towards precision medicine. Blood Rev. 39 (2020) 100618.
Weyand, A. C., Pipe, S. W., New therapies for hemophilia. Blood 133 (2019) 389-398.
Balkaransingh, P., Young, G., Novel therapies and current clinical progress in hemophilia A. Ther Adv Hematol. 9 (2018) 49-61.
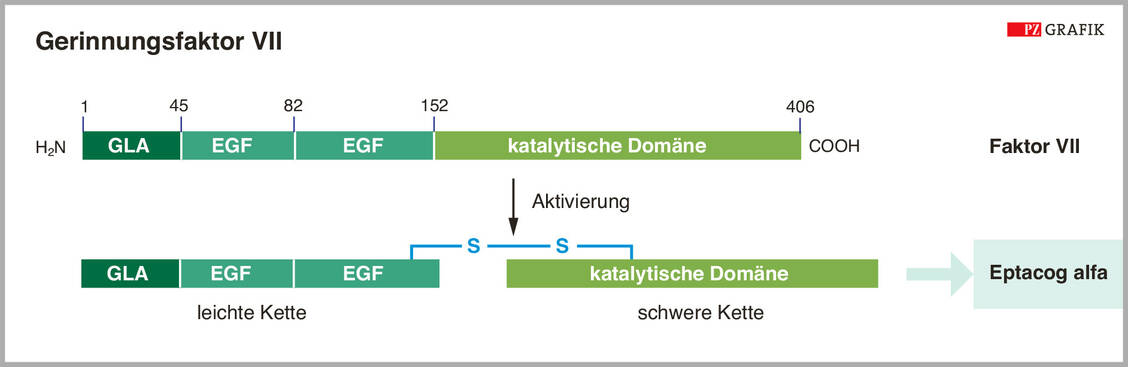
Pedersen, A. H., et al., Autoactivation of human recombinant coagulation factor VII. Biochemistry 28 (1989) 9331-9336.
Jurlander, B., et al., Recombinant activated factor VII (rFVIIa): characterization, manufacturing, and clinical development. Semin Thromb Hemost. 27 (2001) 373-384.
Salas, J., et al., Enhanced Pharmacokinetics of Factor VIIa as a Monomeric Fc Fusion. Thromb Res. 135 (2015) 970-976.
Sandberg, H., et al., Structural and functional characteristics of the B-domain-deleted recombinant factor VIII protein, r-VIII SQ. Thromb Haemost. 85 (2001) 93-100.
Fachinformationen zu den verschiedenen, hier genannten Präparaten.