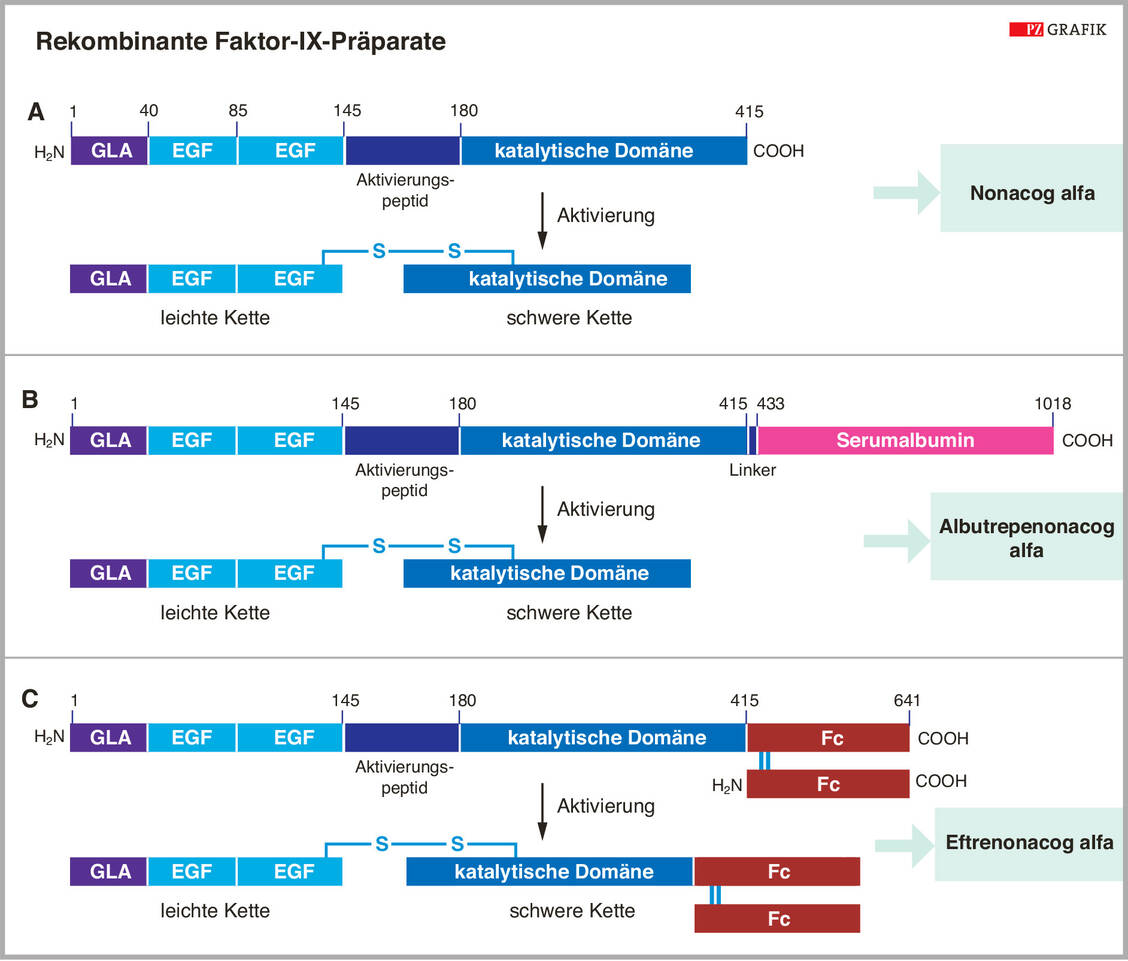
Das Polypeptid aus 415 Aminosäuren wird am N-Terminus umfassend Vitamin-K-abhängig γ-carboxyliert, was für die Bindung von Calcium-Ionen nötig ist. Weitere posttranslationale Modifikationen sind N- und O-Glykosylierung, Phosphorylierung, β-Hydroxylierung und Sulfatierung. Disulfidbrücken sorgen für die korrekte Konformation des Proteins.
Genau diese posttranslationalen Modifikationen und vor allem die γ-Carboxylierung des Proteins waren die Herausforderung der gentechnischen Herstellung. Die Lösung des Problems bestand in der Etablierung einer CHO-Expressionszelllinie, die so verändert wurde, dass sie alle für die γ-Carboxylierung nötigen Enzyme exprimiert. Neben den älteren rekombinant hergestellten Präparaten gibt es Varianten mit verlängerter Halbwertszeit (Tabelle 2), die durch Fusion mit einem Antikörper-Fc-Teil oder mit Albumin beziehungsweise durch Modifikation mit einer PEG-Kette erreicht wurden.