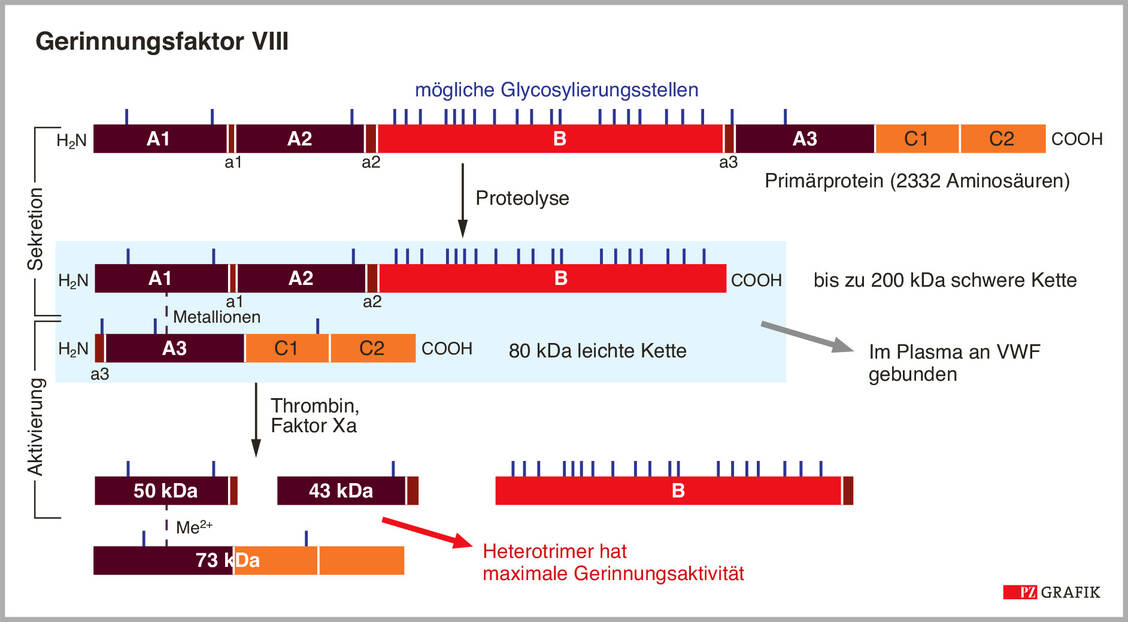
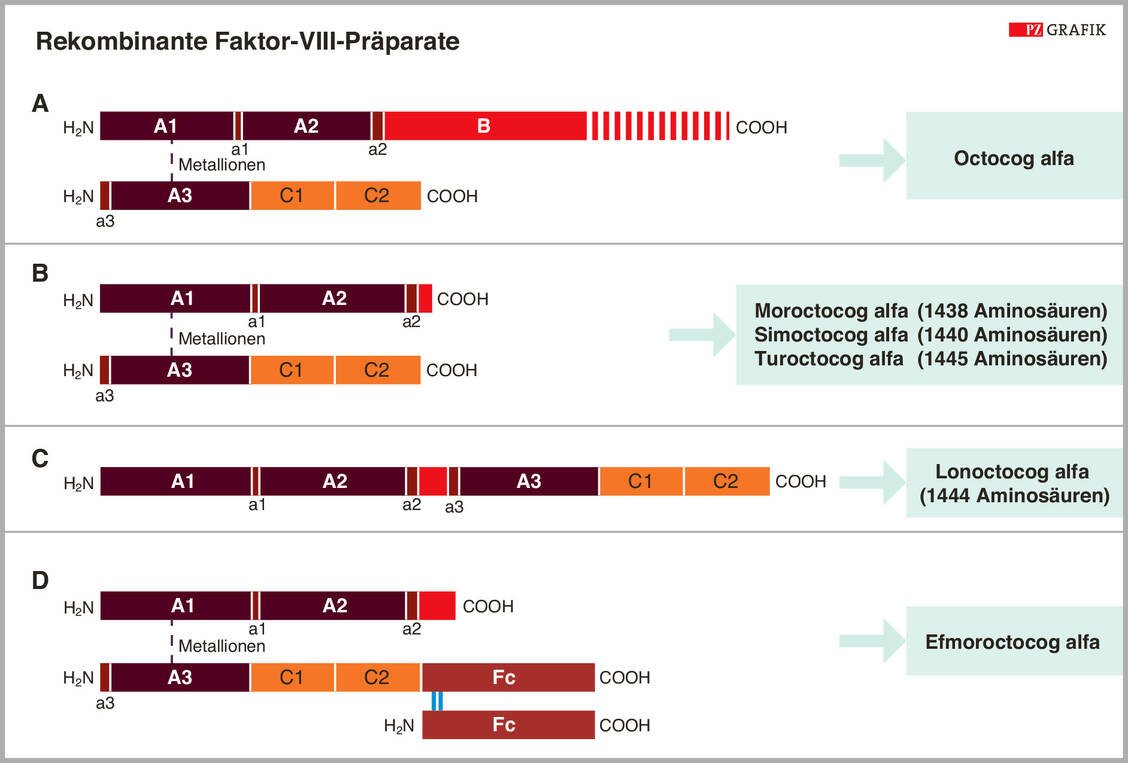
FVIII ist ein Domänenprotein, das aus den Abschnitten A1-A2, B, A3 und C1-C2 besteht (Abbildung 1). Posttranslational kann das Protein an 25 Stellen N-glycosyliert und an sechs Tyrosin-Resten sulfatiert sein. Der ins Blut sezernierte FVIII besteht aus einer zwischen 90 und 200 kDa großen schweren Kette aus A1, A2 und einem mehr oder weniger großen Anteil der Domäne B, die über Metallionen mit der leichten Proteinkette aus A3, C1 und C2 verknüpft ist. Im Plasma sind die beiden FVIII-Proteinketten mit dem von-Willebrand-Faktor (VWF) assoziiert und werden dadurch stabilisiert.
Thrombin oder FXa aktivieren FVIII über eine Spaltung zwischen A1 und A2 sowie zwischen A2 und B, wodurch die B-Domäne komplett entfernt wird. Als Heterotrimer hat FVIIIa die maximale Gerinnungsaktivität und bringt FIXa in die Nähe von FX (Abbildung 1, unten). Dies zeigt, dass die B-Domäne offensichtlich nicht für die Aktivität des Gerinnungsfaktors benötigt wird.