Von der Epidemie, also dem zeitlich und örtlich gehäuften Auftreten einer Infektionskrankheit, sind die Endemie und die Pandemie abzugrenzen.
Bei einer Endemie tritt eine Krankheit in einem begrenzten Bereich mehr oder weniger gleich häufig auf, beispielsweise die Malaria in etwa 100 Ländern tropischer und subtropischer Regionen aller Kontinente – außer Australien. Dagegen spricht man von einer Pandemie, zum Beispiel bei der »Schweinegrippe« oder »Neuen Grippe« 2009, wenn sich eine neue Infektionskrankheit – unabhängig von der Mortalität – über mehrere Länder und Kontinente ausbreitet und somit zwar eventuell zeitlich, aber nicht örtlich begrenzt ist.
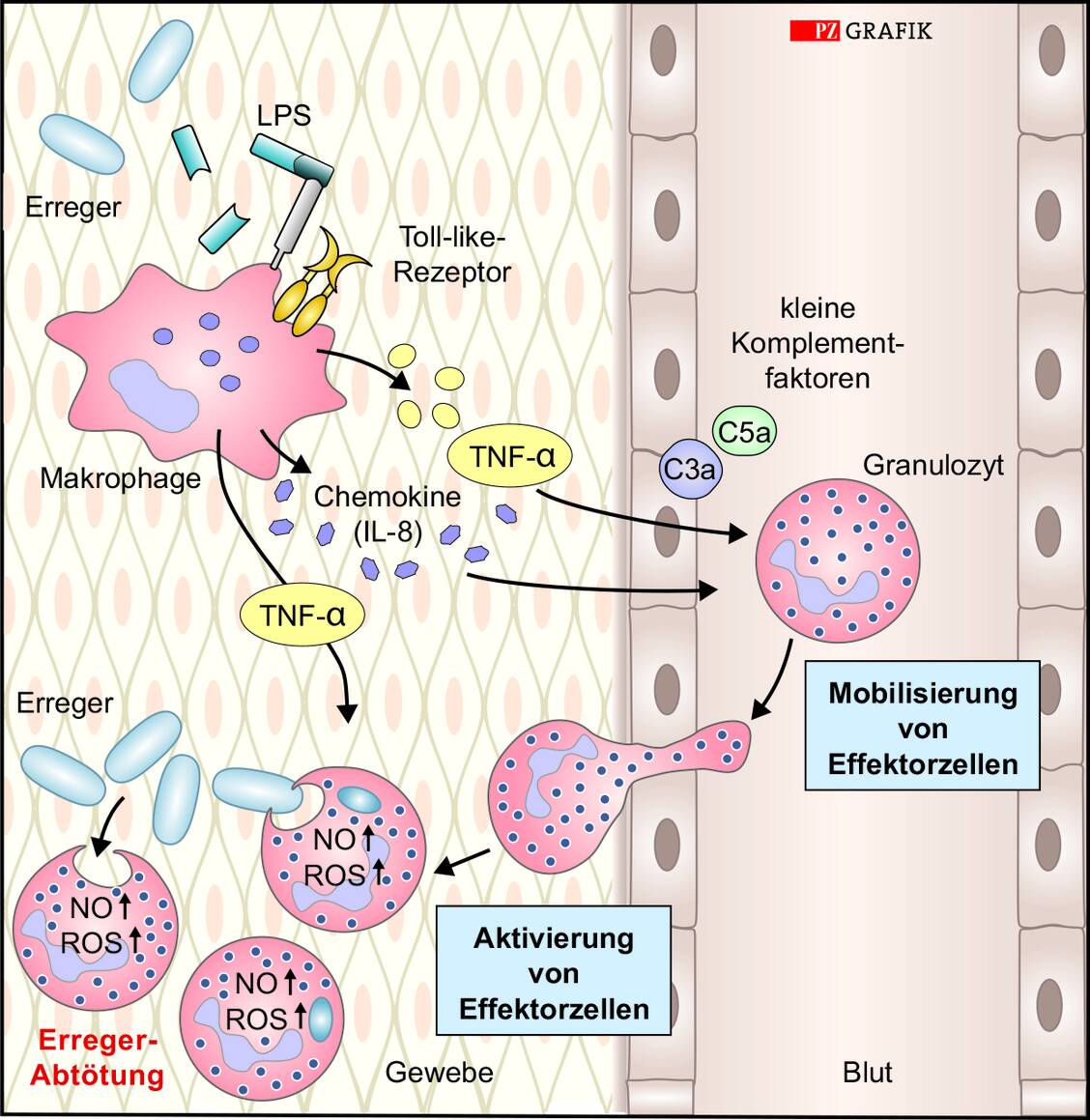
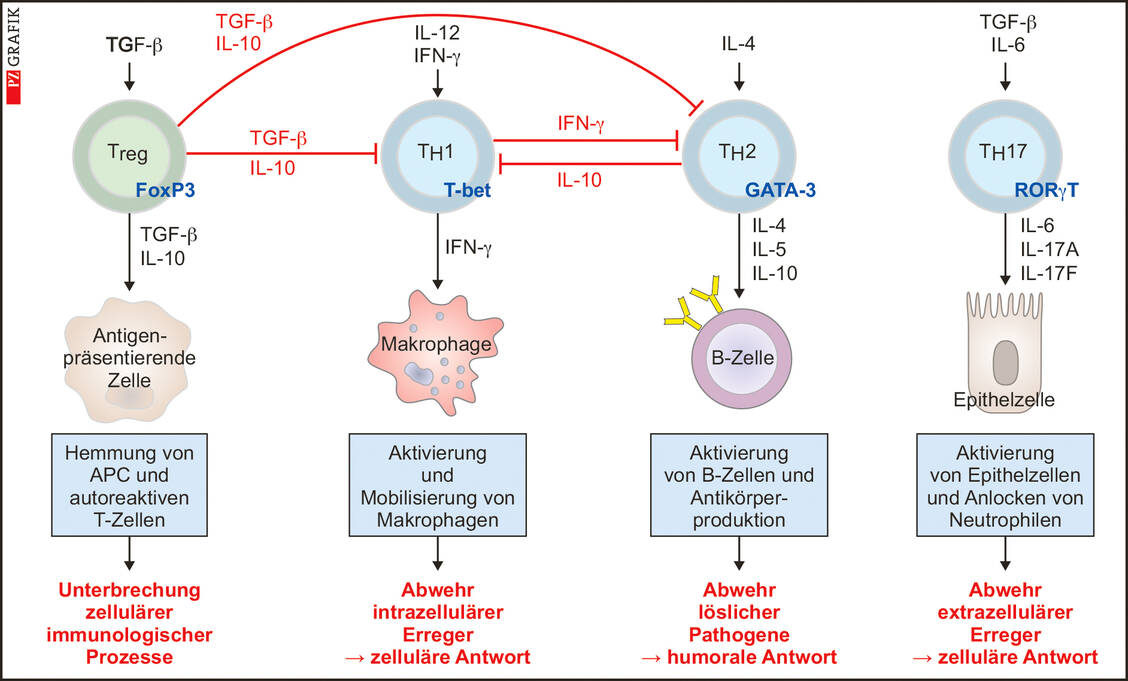
Wie schnell sich eine Epidemie zu einer Pandemie entwickeln kann, hängt unter anderem davon ab, wie gut das Zusammenspiel zwischen dem Immunsystem des Wirts und den Virulenzfaktoren des Pathogens abläuft. Je schlechter das Immunsystem reagiert und je höher dadurch die Replikationsrate und je ausgeprägter die Pathogenität des Erregers ist, desto schneller verstirbt ein Erkrankter und desto weniger gut wird das Pathogen weitergegeben. Hat sich hingegen ein infektiöses Agens, beispielsweise das Herpes-simplex-Virus, gut an den Wirt angepasst und induziert zwar eine Erkrankung, die aber nicht tödlich verläuft, kann dieser Erreger sehr gut weiterverbreitet werden. Kein Wunder also, dass mehr als 90 Prozent der Bevölkerung mit diesem Virus infiziert sind. Nur bei immunsupprimierten Menschen kann es bei einer Infektion mit Herpes-simplex-Viren eventuell zu schlimmeren Komplikationen kommen. In diesem Fall spricht man auch von einer opportunistischen Pathogenität.
Immer dann, wenn der Mensch der alleinige Wirt für das Pathogen ist, lässt sich die Krankheit im Prinzip mit einem guten Impfprogramm ausrotten. Für Pocken ist dies schon gelungen, für Polio ist das Ziel zum Greifen nahe und für Masern wäre die Eradikation rein theoretisch auch möglich. Ganz anders sieht es hingegen bei der Influenza aus. Grippeviren sind nicht sehr wählerisch, was ihre Wirtsorganismen angeht, und können – allerdings mit unterschiedlicher Effektivität – Vögel, Schweine, Pferde und andere Tiere infizieren. Genau dadurch wächst die Gefahr, dass eine Influenza-Pandemie ausbricht.