Seit vielen Jahren ist bekannt, dass virale Infektionen offensichtlich mit der Induktion der MS korrelieren. Daher hat kürzlich eine beweiskräftige Studie zum Zusammenhang der MS-Inzidenz mit einer früheren Infektion mit Epstein-Barr-Viren (EBV) große Aufmerksamkeit auf sich gezogen. Diese epidemiologischen Daten beweisen, dass eine Infektion mit EBV das Risiko, an MS zu erkranken, um das 32-Fache gegenüber EBV-negativen Probanden erhöht (3).
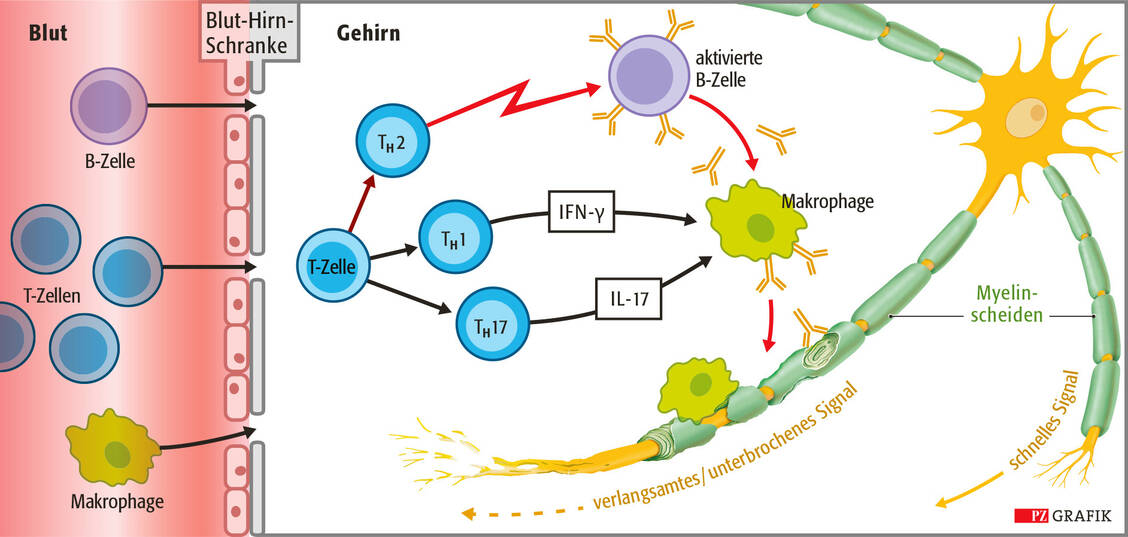
Mit zunehmenden Einblicken in die vielfältigen, auch immunologisch steuernden Funktionen der intestinalen Mikrobiota (Darmbakterienflora) werden auch Zusammenhänge mit der MS-Erkrankung deutlich. Fakt ist, dass die Patienten eine veränderte Zusammensetzung der Mikrobiota gegenüber Gesunden aufweisen, was zum Ungleichgewicht zwischen aktivierten T-Zellen (TH17) und immunsuppressiven Treg-Zellen beitragen kann. Studien belegen, dass durch die mikrobielle Imbalance bestimmte Regulatorstoffe, zum Beispiel Propionsäure, fehlen. Eine Patientenstudie mit therapeutisch immunmodulierten MS-Erkrankten zeigte eindrucksvoll, dass die orale Supplementierung von Natriumpropionat die Immunbalance und die Symptomatik positiv beeinflusst (4). Der genaue Mechanismus ist unbekannt.