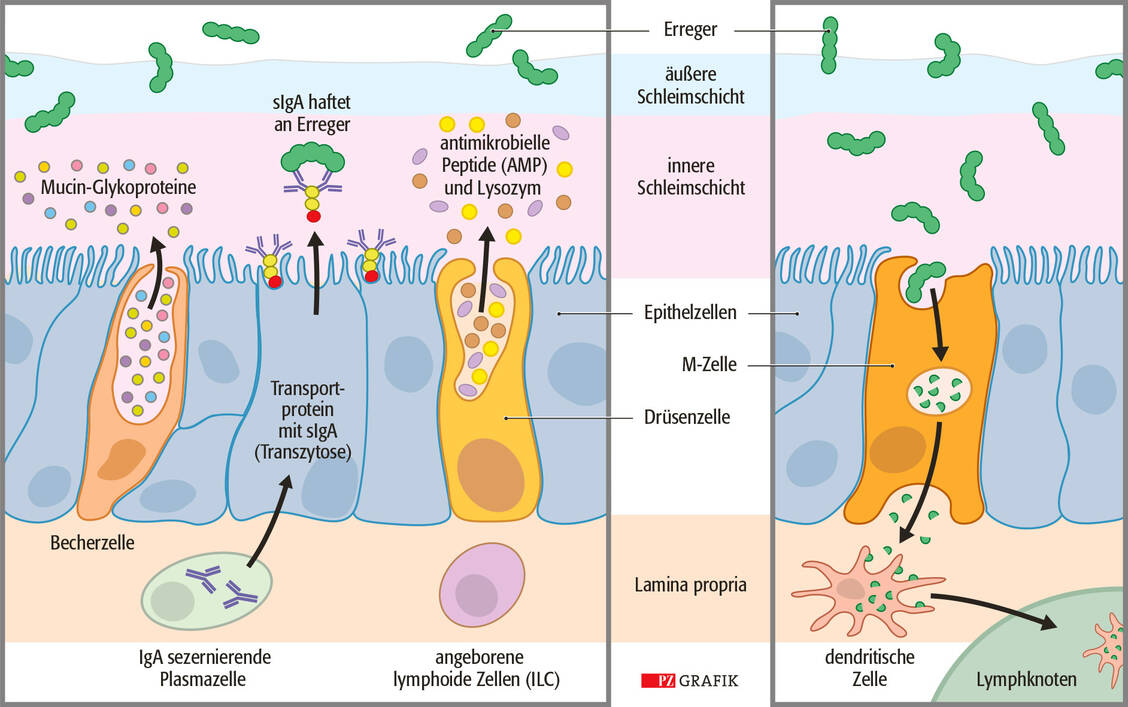
Erwachsene erleiden im Durchschnitt jährlich zwei bis vier, Kinder sechs bis acht Atemwegsinfekte, meist in Form einer akuten viralen Rhinitis. Dass es nicht wesentlich häufiger dazu kommt, liegt an der Aktivität des NALT-Systems (nasal assoziiertes lymphatisches Gewebe), das viele Erreger schon an der Eintrittspforte abwehrt.
Die infektiöse Entzündung der Nasenschleimhaut (Rhinitis) wird meist durch Tröpfcheninfektion mit Rhinoviren, Respiratorischem Synzytial-Virus, Parainfluenza-, Corona- oder humanem Bocavirus verursacht. Bei etwa 2 Prozent der Patienten kommt es zusätzlich zur akuten bakteriellen Besiedelung. Bei dieser Rhinosinusitis sind die Nasen- und Nasennebenhöhlen betroffen; neben verstopfter Nase, vermehrtem Nasensekret und Riechstörungen können auch Fieber und Kopfschmerzen auftreten. Mehr als drei Viertel aller Erkrankungen bessern sich innerhalb von zwei Wochen auch ohne Therapie. Erst bei einer Dauer von mehr als zwölf Wochen wird von einer chronischen Form gesprochen (2).
Für die Anamnese wichtig ist auch die Abgrenzung der viralen/bakteriellen Entzündung von der allergischen Rhinitis, an der jeder Zweite bis Dritte in Europa leidet (2, 3).
Eine akute Rhinosinusitis wird recht unterschiedlich behandelt. Der Nutzen von Antibiotika und sogenannten Erkältungsmitteln ist umstritten, die Evidenz unterschiedlich gut beschrieben (3). Es wurde gezeigt, dass bei Kindern Ibuprofen stärker antipyretisch wirkt als Paracetamol. Außerdem gibt es Hinweise auf eine therapeutische Wirksamkeit von Zink, Probiotika mit milchsäurebildenden Bakterien sowie Honig.
Allemal wichtig ist es, die Nasenschleimhaut vor Rauch und Giftstoffen zu schützen und nicht austrocknen zu lassen. Eine Rhinitis sicca (trockene Nase) entwickelt sich besonders leicht bei trockener kalter Luft und bei Übergebrauch von Nasentropfen oder -sprays mit Vasokonstringenzien. Das Spektrum der Behandlungsmöglichkeiten ist groß, die Bandbreite der Evidenz ebenso (3, 4).