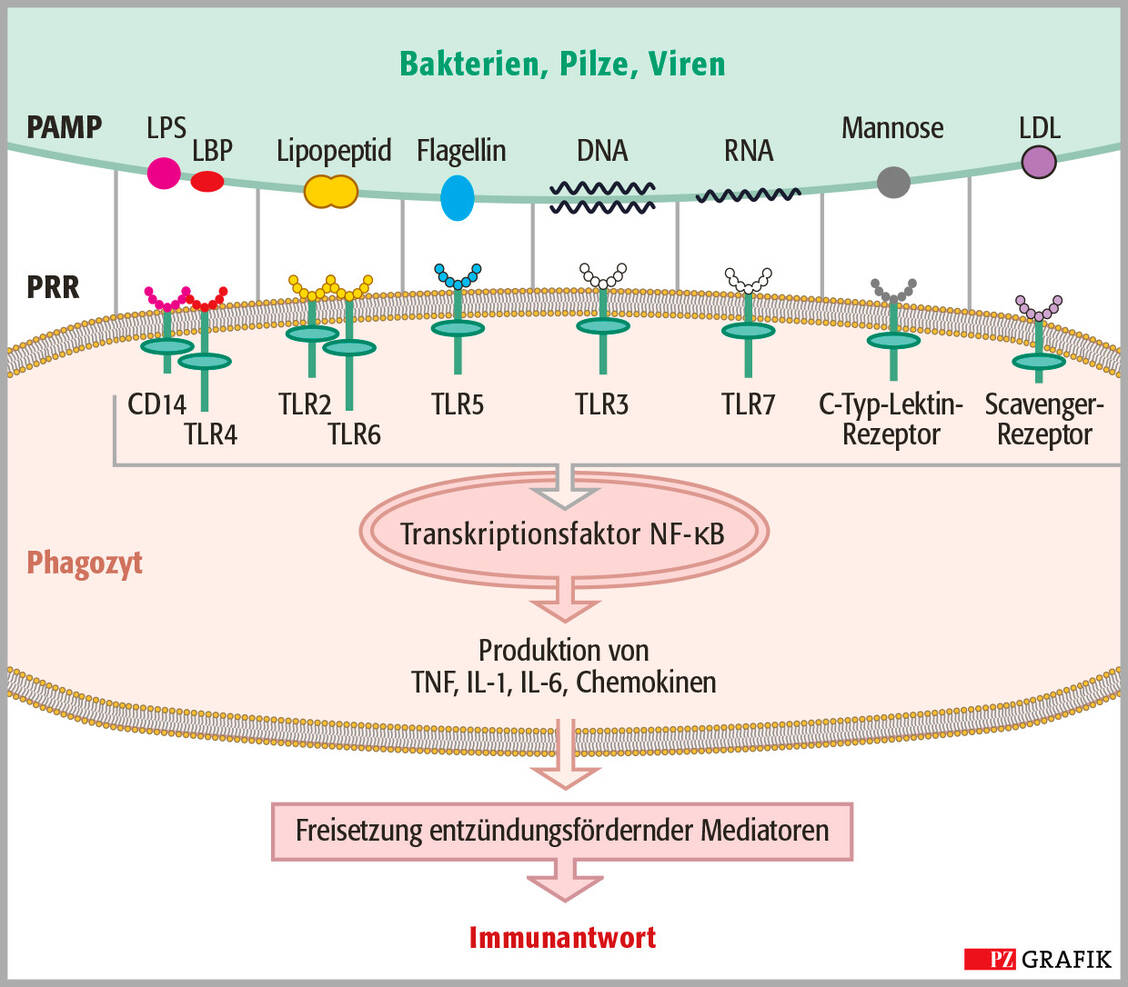
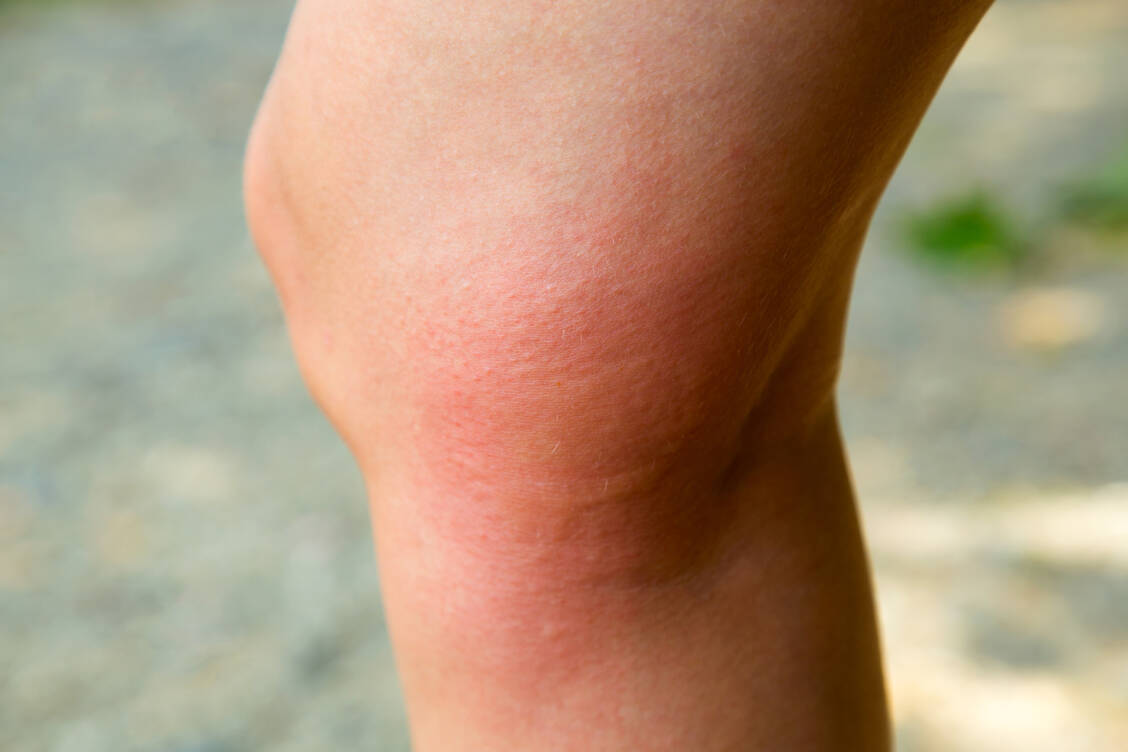
Sei es eine Rhinitis, eine Enteritis oder eine infizierte Wunde: Das finale Ziel einer Entzündungsreaktion (Inflammation) ist es, Eindringlinge und Fremdstoffe zu beseitigen, ihre Ausbreitung zu verhindern und die Gewebehomöostase wiederherzustellen. Das Entzündungsgeschehen ist ein komplexer Prozess, an dem Antikörper, Entzündungsmediatoren und Immunzellen beteiligt sind.
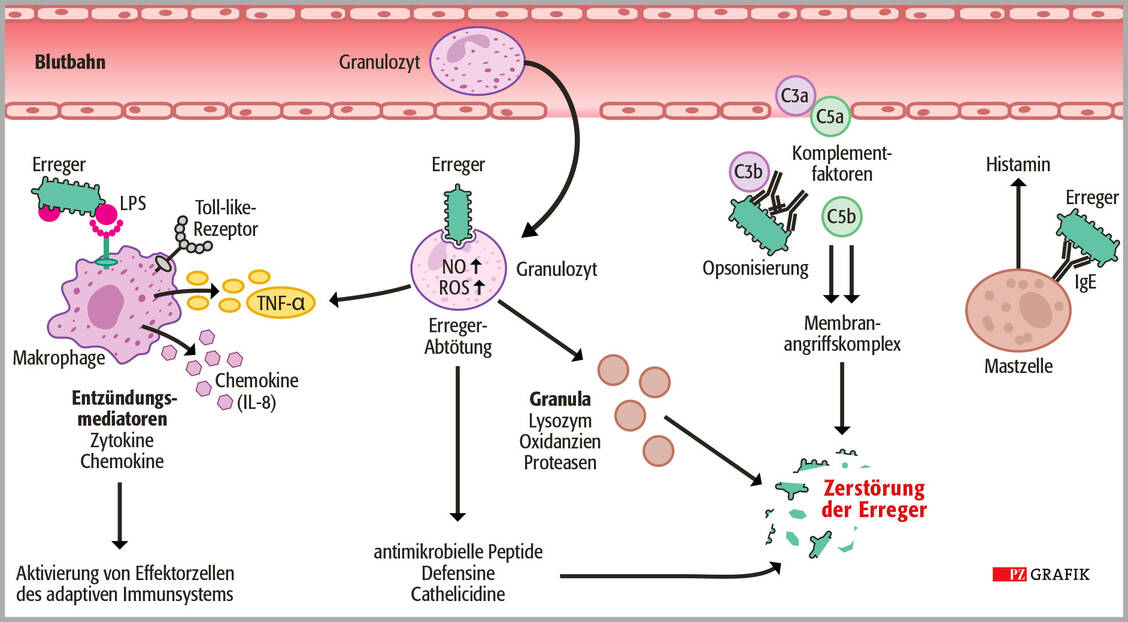
An vorderster Front stehen sogenannte Fresszellen wie neutrophile Granulozyten und Makrophagen, die im Knochenmark gebildet werden und in Blut und Gewebe zirkulieren. Erhöhte Werte von Granulozyten und Monozyten (die im Blut zirkulierenden Vorläufer der Makrophagen) in einer Blutprobe deuten auf eine Infektion hin. Es gibt drei Typen von Granulozyten: Neutrophile Granulozyten sind auf die Abwehr von Bakterien spezialisiert, eosinophile auf Parasitenbefall. Eosinophile sowie basophile finden sich besonders bei IgE-vermittelten Allergien.
Sobald Monozyten ins Gewebe einwandern, differenzieren sie zu Makrophagen, die eine ausgezeichnete Fähigkeit zur Phagozytose haben, das heißt besonders gut Fremdmaterial aufnehmen können. Stoßen sie auf Bakterienbruchstücke, senden sie Mediatoren wie Zytokine und Chemokine aus, die Granulozyten zum Infektionsherd locken und aktivieren (Abbildung 1). Diese setzen Enzyme wie Lysozym und Proteasen sowie Oxidanzien aus ihren Vesikeln (Granula) frei, wodurch die Erreger zerstört und im Anschluss phagozytiert, also regelrecht »aufgefressen« werden – daher auch die Bezeichnung »Fresszellen« (Phagozyten).