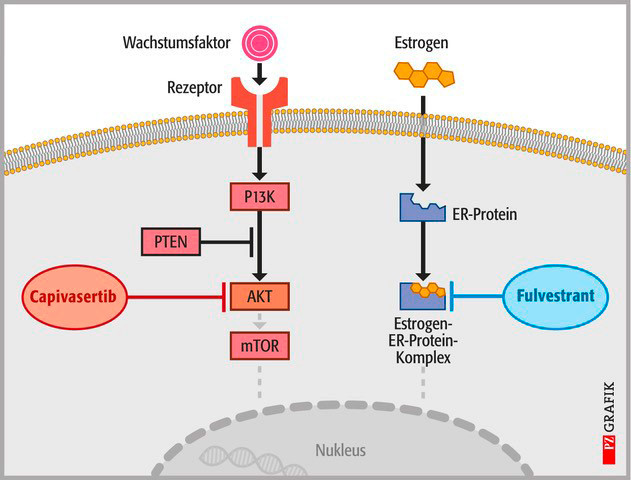
Ein bisschen erinnert Capivasertib an Alpelisib. Dieser Wirkstoff ist auch in Kombination mit Fulvestrant beim lokal fortgeschrittenen oder metastasierten ER-positiven und HER2-negativen Brustkrebs nach Versagen einer endokrinen Therapie zugelassen. Auch Alpelisib, das der Hersteller aus wirtschaftlichen Gründen aber in Deutschland nicht mehr vermarktet, greift in den PI3K/AKT-Signalweg ein.
Die AKT-Kinase ist ein attraktives Ziel für die Entwicklung von Krebsmedikamenten, weil sie einer der wichtigsten Knotenpunkte in einem Signalnetzwerk ist, das bei vielen Krebsarten gestört ist, unter anderem bei Brustkrebs. Capivasertib ist nun der erste selektive AKT-Inhibitor und sorgt dafür, dass der überaktive PI3K-Signalweg herunterreguliert wird. Schon aufgrund dieses neuen Wirkmechanismus ist der neue Wirkstoff als Sprunginnovation zu betrachten.
Auch die Ergebnisse der zulassungsrelevanten Studie, insbesondere der Vorteil beim progressionsfreien Überleben, untermauern diese Einstufung. Besonders positiv ist ferner, dass Capivasertib ein Arzneistoff mit Potenzial für mehrere Indikationen ist und bereits eine Reihe weiterer klinischer Studien laufen, etwa beim schwer zu behandelnden dreifach negativen Brustkrebs oder in Kombination mit Abirateron bei Prostatakrebs.
Capivasertib ist wirksam, allerdings keineswegs frei von Nebenwirkungen. Hierauf müssen auch Apotheker bei der Abgabe von Truqap® achten und zum Beispiel auf die Kontrolle des Blutzuckerspiegels aufmerksam machen, der unter Capivasertib ansteigen kann. Auch hier zeigt sich übrigens eine Parallele zu Alpelisib, das ebenfalls Hyperglykämien auslösen kann. Zudem gilt es mit Blick auf mögliche Wechselwirkungen, bei einer Therapie mit Capivasertib wachsam zu sein: Die Begleitmedikation sollte auf CYP3A4-Hemmer und -Induktoren gescreent werden und falls vorhanden gegebenenfalls gehandelt werden.
Sven Siebenand, Chefredakteur