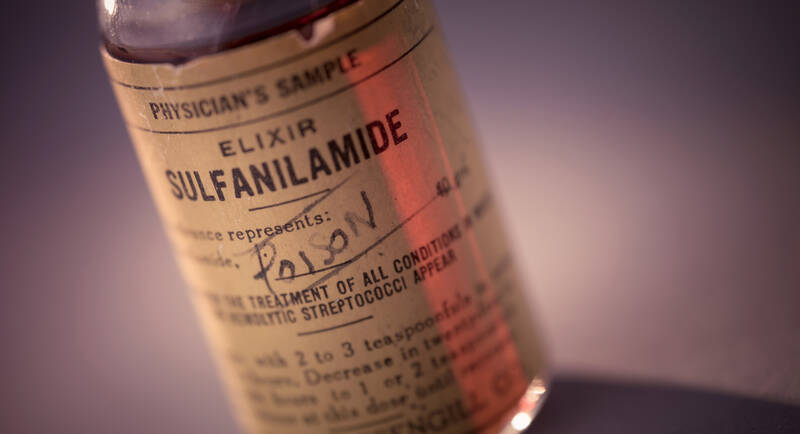Die Firma Massengill aus Bristol, Tennessee, hatte nach der Vermarktung von Sulfonamid-Kapseln und Tabletten in den 1930er-Jahren beschlossen, auch einen Sirup herzustellen. Die gesamte Gruppe der Sulfonamide ist bekannt für ihre schlechte Löslichkeit und einen bitteren Geschmack. Harold Watkins, der Chemiker in der neu gegründeten Firma, suchte daher nach einem geeigneten Lösungsmittel für Sulfanilamid und kam zu folgender Rezeptur:
- 10 Prozent Sulfanilamid,
- 72 Prozent Diethylenglykol,
- 16 Prozent Wasser
- sowie kleine Mengen Himbeer-Extrakt, Saccharin-Lösung, Amaranth und Karamell.
Diethylenglykol schmeckt süßlich und ist ein exzellentes Lösungsmittel, aber leider toxisch. Dies hatten Studien bereits kurz vor der Markteinführung des Elixirs gezeigt, was Watkins aber offensichtlich nicht wusste. Diethylenglykol kann Nierenversagen verursachen und zu Leberschäden führen, besonders bei Kindern unter fünf Jahren.
Als die ersten Todesfälle bekannt wurden, versuchte man, Drogisten, Verkäufer und Ärzte durch Versendung von Telegrammen zu informieren, was aber nicht reibungslos funktionierte. Daher wurden auch noch Angestellte der damaligen FDA ins Land geschickt, um das Elixir schneller einzusammeln. Über die Irrungen und Wirrungen dieser Aktion hat die FDA-Redakteurin Carol Ballentine sehr emotional berichtet.
Der Besitzer der Pharmafirma, Dr. S. E. Massengill, sagte dazu, dass ihm der Fall leidtäte, dass aber keinerlei Verantwortung bei ihm läge, da dies ein unvorhersehbares Ereignis gewesen sei. Er wurde später zu 26.000 US-Dollar Strafe verurteilt, weil er an 112 Fällen der Fälschungen für schuldig befunden wurde. Der Chemiker Watkins hat Suizid begangen.
Literatur
Wax, P. M., Elixir, Diluents, and Passage of the 1938 Federal Food, Drug and Cosmetic Act. Ann. Intern Med. 122, 456–461 (1995).
Ballentine, C., Sulfanilamide Disaster. FDA Consumer Magazine, Juni 1981 US FDA; www.fda.gov/about-fda/histories-product-regulation/sulfanilamide-disaster; abgerufen am 14. August 2023.