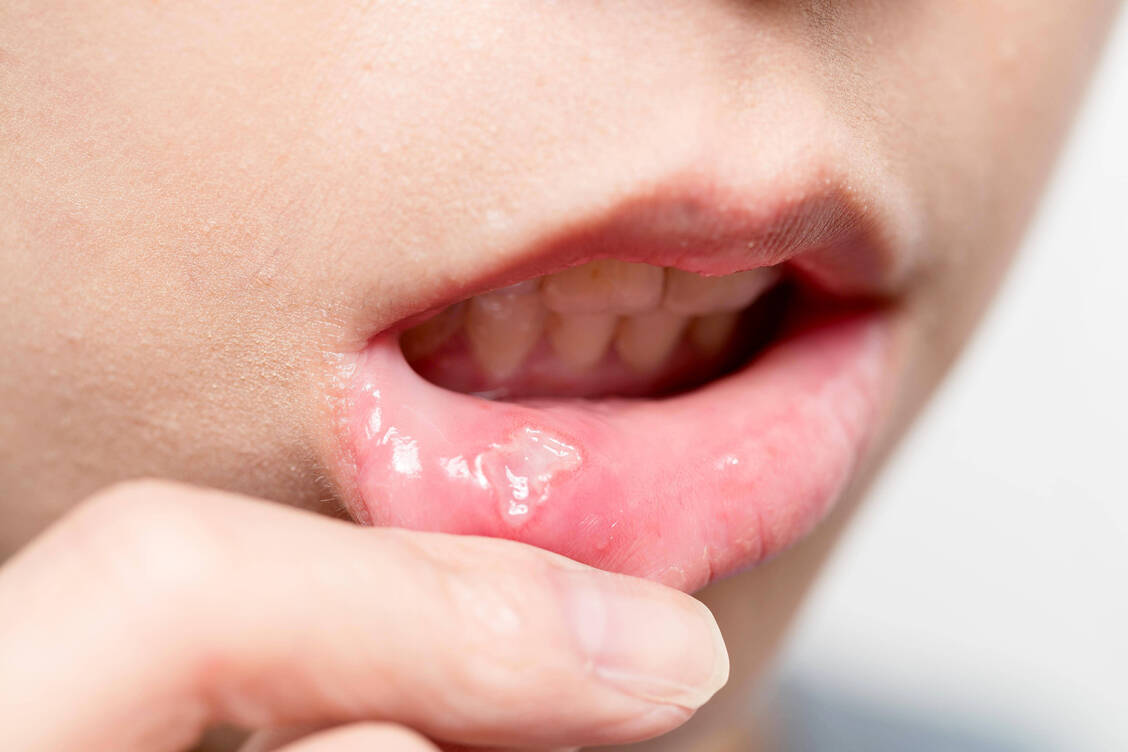
Betroffen sind insbesondere Personen mit prädisponierenden Faktoren; dazu zählen beispielsweise Nahrungsmittelallergien (etwa Schokolade, Erdnüsse, Eier), lokale Schleimhautverletzungen (durch scharfe Zähne, Zahnbehandlung), Medikamente (Antibiotika, Antiepileptika, Diuretika, Chemotherapeutika, entzündungshemmende und antiretrovirale Medikamente), endokrine Störungen (Zöliakie, Diabetes mellitus, Autoimmunerkrankung der Schilddrüse) oder Stress.
Gemäß einer europäischen Leitlinie von 2022 gibt es keine definierte Behandlung für die Stomatitis aphthosa (26). Um die Beschwerden zu lindern, werden topische Corticosteroide, Antibiotika und Analgetika empfohlen. Diese sollten jedoch unter ärztlicher Aufsicht, zeitlich begrenzt und nicht zu häufig angewandt werden, da Pilzinfektionen, Resistenzen oder Nebenwirkungen auftreten könnten. So erwies sich Chlorhexidindigluconat (in oralen Antiseptika) zytotoxisch gegenüber menschlichen Fibroblasten und Osteoblasten. Systemische, nicht steroidale Antirheumatika oder Steroide zeigten gastrointestinale und kardiale Toxizität sowie nephrotoxische Nebenwirkungen (26). In manchen Fällen kann die Einnahme von Vitamin B1, B2, B6, B12, Folat oder Eisen die aphthöse Stomatitis verbessern (27).