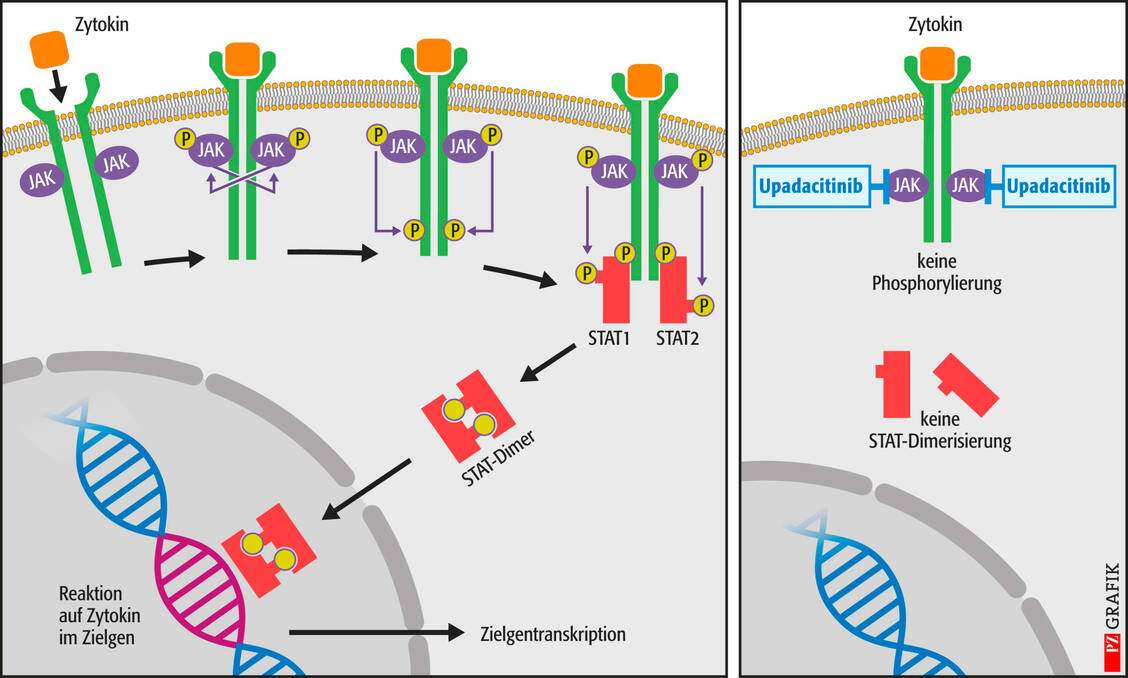
Hinsichtlich seines Wirkmechanismus bietet Upadacitinib keinen grundlegenden Vorteil gegenüber den anderen bekannten Januskinase-Hemmern. Seine Wirksamkeit bei rheumatoider Arthritis hat er zweifelsohne in einem umfangreichen Studienprogramm nachgewiesen. Jedoch wären direkte Vergleichsstudien mit den anderen JAK-Hemmern wünschenswert. So ist der therapeutische Fortschritt nicht erkennbar.
Auch das zugelassene Anwendungsgebiet erschließt bislang keine neue Patientengruppe. Im Vergleich zu Tofacitinib, das zum Beispiel auch bei Colitis ulcerosa zum Einsatz kommen darf, ist es sogar schmaler. Das kann sich demnächst jedoch ändern. Denn aktuell laufen Phase-III-Studien mit Upadacitinib, zum Beispiel bei Morbus Crohn und atopischer Dermatitis. Vorläufig ist der neue Wirkstoff aber bei den Analogpräparaten einzustufen.
Sven Siebenand, Chefredakteur