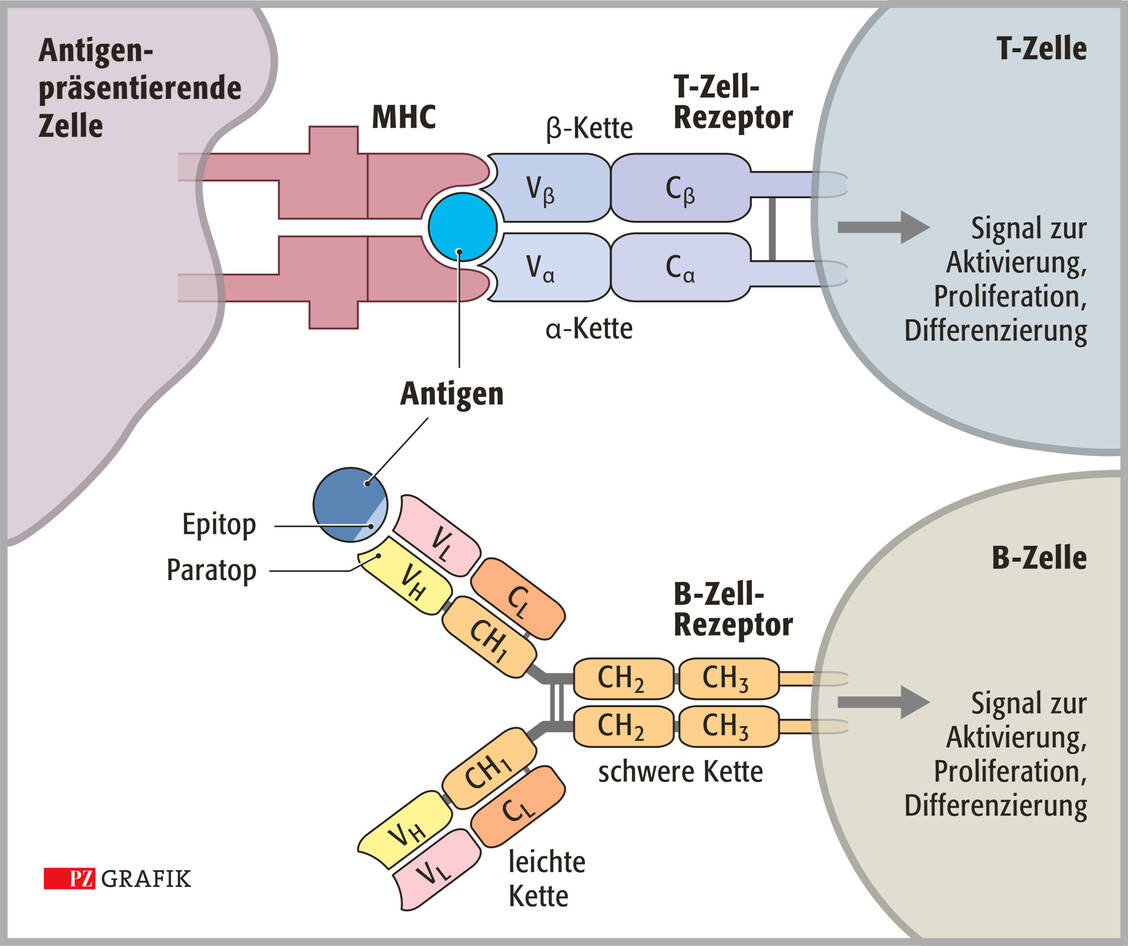
Das angeborene beziehungsweise unspezifische Immunsystem setzt sich auf zellulärer Ebene aus Monozyten/Makrophagen, verschiedenen Granulozyten, Mastzellen, verschiedenen angeborenen Lymphoid-Zellen (innate lymphoid cells, ILC), zu denen auch die natürlichen Killerzellen (NK) gehören, sowie dendritischen Zellen (DC) zusammen. Diese Zellen werden in einer ersten schnellen Immunantwort unterstützt von den humoralen, also löslichen Komponenten des unspezifischen Immunsystems: dem Komplementsystem, den Zytokinen und unterschiedlichen antibakteriellen Proteinen. Eindringende Bakterien oder Viren werden relativ unspezifisch anhand allgemeiner Muster erkannt. Die DC dienen als Vermittler zum adaptiven Immunsystem, das sehr viel spezifischer, aber auch verzögert reagiert.