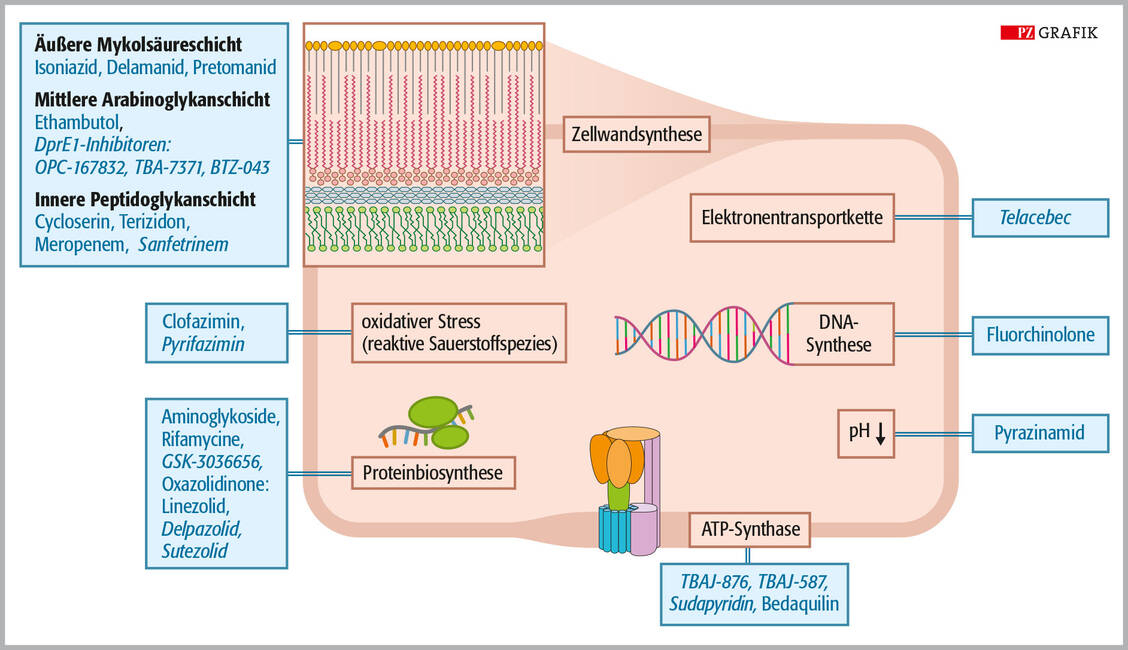
Am weitesten fortgeschritten in der Entwicklung neuer TB-Impfstoffe ist VPM 1002, eine rekombinante BCG-Vakzine, die am Max-Planck-Institut in Göttingen von der Arbeitsgruppe um Professor Dr. Stefan Kaufmann entwickelt wurde. VPM 1002 enthält ein gentechnisch modifiziertes Mycobacterium bovis vom BCG-Subtyp Prag. Diese Bakterien wurden so verändert, dass das Gen hly in das bakterielle Genom integriert wurde. Dieses Gen codiert für das membranperforierende Protein Listeriolysin O (Hly) aus Listeria monocytogenes. Das Protein sorgt dafür, dass die phagosomale Membran von Wirtszellen, die VPM 1002 in sich tragen, durchlöchert wird, sodass die Antigene ins Zytosol gelangen können. Dadurch wird der Zelltod dieser Zellen induziert. Zudem scheint dies auch die MHC-basierte Antigenpräsentation zu erleichtern und damit die T-Zellantwort zu stimulieren. Damit Listeriolysin wirken kann, benötigt es einen sauren pH-Wert von deutlich unter 6. Dies wird durch die Deletion des Urease-C-Gens erreicht. Wird Urease C nicht produziert, bleibt der pH-Wert im sauren Bereich (18).