Bei pränatalen Infektionen kommt es zur Virusübertragung von der Mutter auf den Fetus während der Schwangerschaft (kongenital) (53). Mit einer Prävalenz von etwa 1 Prozent ist die kongenitale Infektion mit dem Cytomegalievirus (CMV) weltweit am häufigsten (54). Eine intrauterin übertragene CMV-Infektion verläuft beim Fetus meistens asymptomatisch, kann jedoch auch zu Mikrozephalie, niedrigem Geburtsgewicht, Hepatomegalie oder neurologischen Störungen führen. Eine postnatale CMV-Infektion über die Muttermilch der erkrankten Mutter ist ebenfalls möglich, wenn auch seltener. Die Behandlung einer fetalen CMV-Infektion wird nicht empfohlen (55). Zur symptomatischen Behandlung der Neugeborenen stehen die Nukleosidanaloga Ganciclovir und Valganciclovir (beide off Label) zur Verfügung (31, 53, 55, 56).
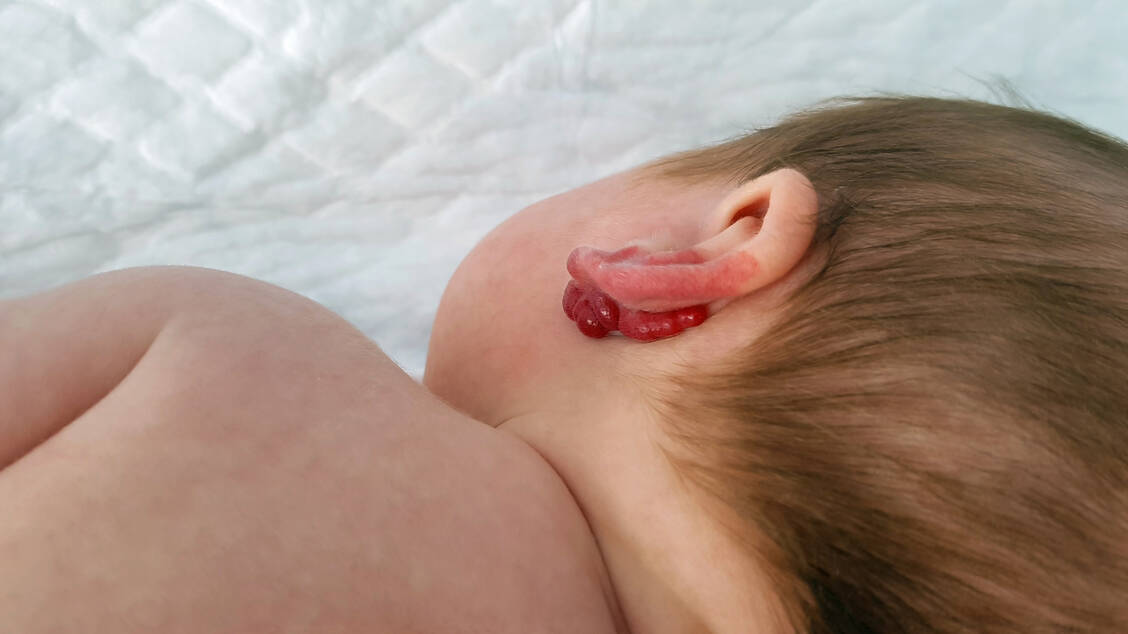
Perinatale Infektionen werden während des Geburtsvorgangs von der Mutter auf das Neugeborene übertragen (53). Eine Infektion mit Herpes-simplex-Viren (HSV) beim Neugeborenen löst klassische Symptome wie Hautläsionen und neurologische Störungen, aber auch unspezifische Symptome wie Fieber und Schwäche aus (57). Der Therapiestandard besteht aus hoch dosiertem Aciclovir (60 mg/kg KG, zugelassen), je nach Symptomatik über 14 bis 21 Tage (58, 59).