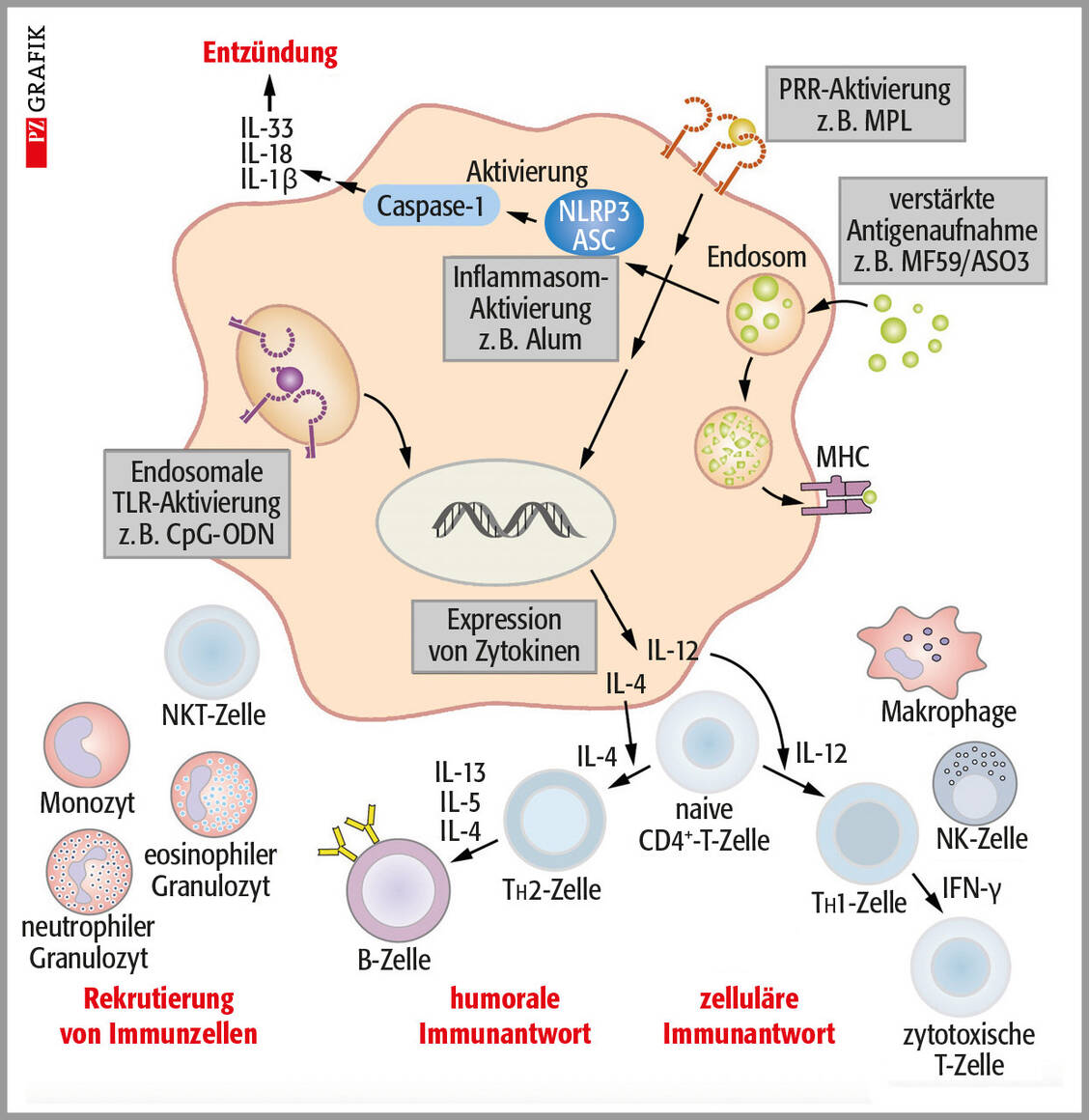
Mit dem Größer- und Erwachsenwerden reift das Immunsystem aus. Jedoch kann es aus diversen Gründen zu einer Immunsuppression kommen. Bestimmte genetische Prädispositionen, Infektionen mit Influenza- oder Epstein-Barr-Virus, Arzneimittel und Krankheiten, aber auch Unterernährung oder chronischer Stress können sich mehr oder weniger stark auf die Funktionalität des Immunsystems auswirken. Die betroffenen Personen leiden vermehrt unter einfachen Infektionen und sollen keine Lebendimpfstoffe erhalten.
Im Lauf des Lebens kommt es zur allgemeinen Alterung der Körperzellen, die auch das Immunsystem beeinträchtigt. Besonders gravierend wirkt sich die Schrumpfung des Thymus auf die Immunantwort aus. Der Thymus ist für die Differenzierung und Reifung der T-Lymphozyten verantwortlich und verliert bereits ab der Pubertät an Größe und Funktionalität mit der Folge, dass die Anzahl naiver T-Zellen allmählich abnimmt. Auch bei den B-Lymphozyten sinkt die Anzahl der naiven Zellen. Stattdessen kommen vermehrt Antigen-erfahrene Gedächtniszellen vor, die jedoch zum Teil bereits etwas »ausgelaugt« sind.