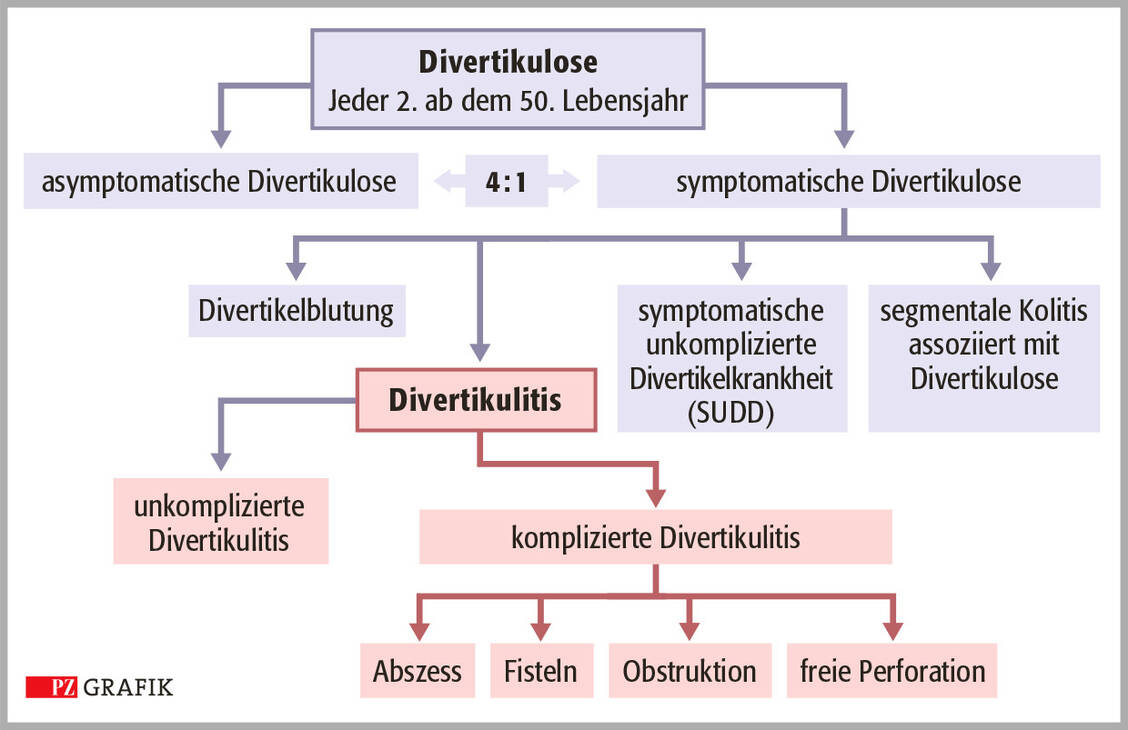
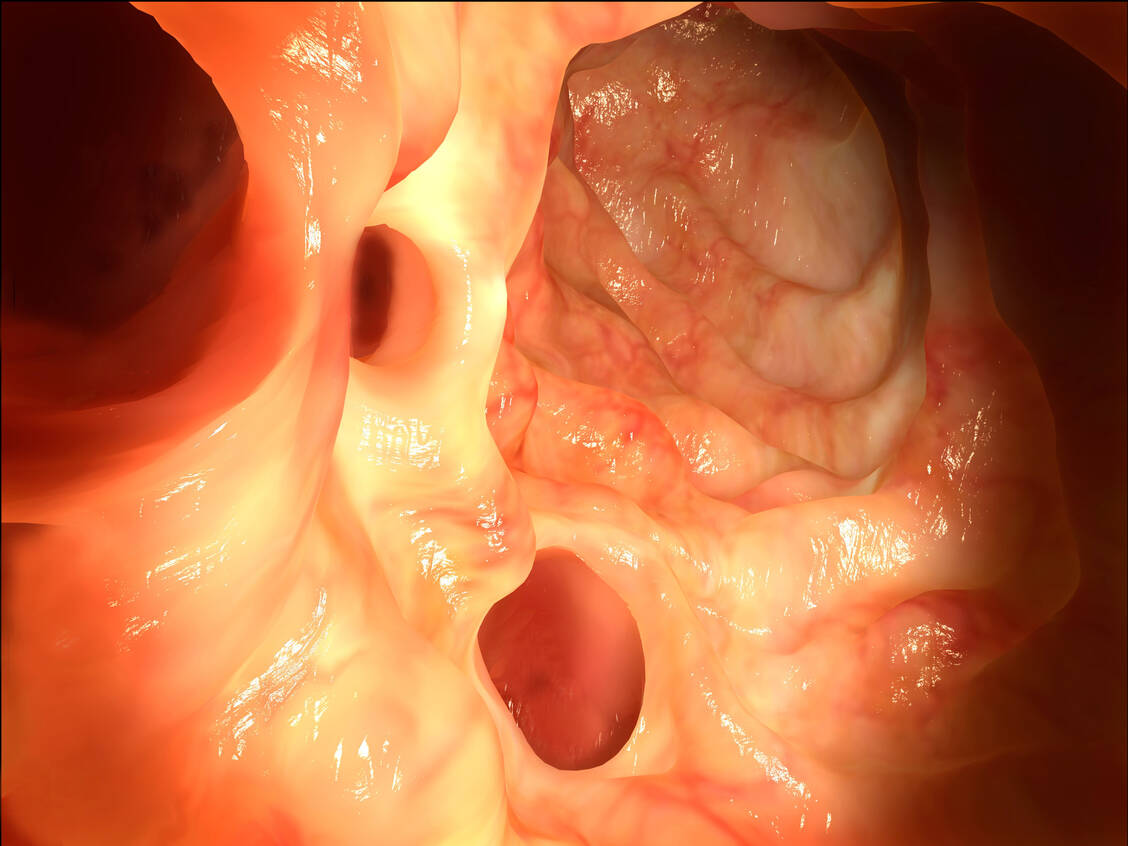
Laut der S3-Leitlinie (3) liegt eine Divertikelkrankheit des Kolons vor, wenn es bei bestehender Divertikulose zu Symptomen, einer Entzündung und/oder Komplikationen kommt. Die Divertikulitis ist eine Entzündung, die in der Regel von einem Divertikel ausgeht und plötzlich dumpfe Bauchschmerzen, leichtes Fieber, Druckgefühl, Blähungen und Stuhlunregelmäßigkeiten wie Verstopfung und/oder Durchfall auslösen kann. Die Divertikulitis selbst kann man nach dem Schweregrad noch in eine unkomplizierte und eine komplizierte Form unterteilen und bei der Letzteren die Art der Komplikation anführen, zum Beispiel Abszess, Fistelbildung, Bauchfellentzündung oder Darmdurchbruch. Dann handelt es sich um eine akute komplizierte Divertikulitis. Im Gegensatz dazu ist die chronische Divertikulitis gekennzeichnet durch rezidivierende oder persistierende Entzündungsschübe, die zu Komplikationen (Stenose, Fisteln) führen können (Grafik).