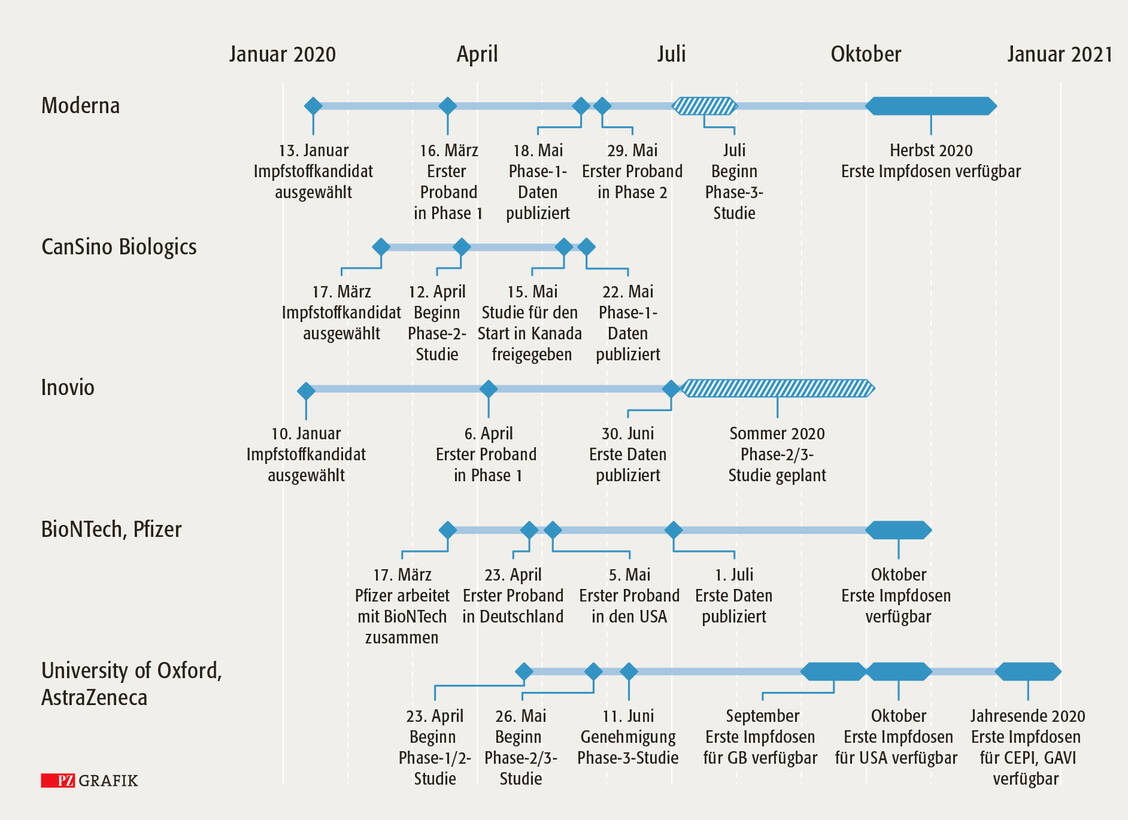
Am 23. April erhielt das Konsortium vom Paul-Ehrlich-Institut (PEI) die Genehmigung, eine erste Corona-Impfstoffstudie in Deutschland durchzuführen. Kurze Zeit später folgte eine ähnliche Studie in den USA. Im Gegensatz zu Moderna und anderen Frühstartern testeten BioNTech und Pfizer vier Prototypen simultan.
Die Ergebnisse der Phase-I/II-Studie (NCT04368728) mit dem Kandidaten BNT162b1 wurden am 1. Juli bekannt gegeben. BNT162b1 ist eine Lipid-Nanopartikel-Formulierung einer mRNA, die für die Rezeptorbindedomäne (RBD) des Spike-Proteins von SARS-CoV-2 in einer bestimmten Konformation kodiert. Die Studienergebnisse zeigen, dass die Impfung bei drei Dutzend gesunden Erwachsenen zu ermutigenden Immunreaktionen führte. Die Probanden in den niedrig dosierten Verumgruppen (10 µg beziehungsweise 30 µg der mRNA-Vakzine BNT162b1) hatte jeweils zwei Injektionen im Abstand von 21 Tagen erhalten, die Probanden in der am höchsten dosierten Verumgruppe (100 µg der mRNA-Vakzine BNT162b1) waren aufgrund von Verträglichkeitsproblemen nur einmal geimpft worden.
Eine großangelegte Phase-II/III-Studie soll im späten Juli beginnen. Im Oktober sollen nach Angaben des Konsortiums erste Impfdosen zur Verfügung stehen.