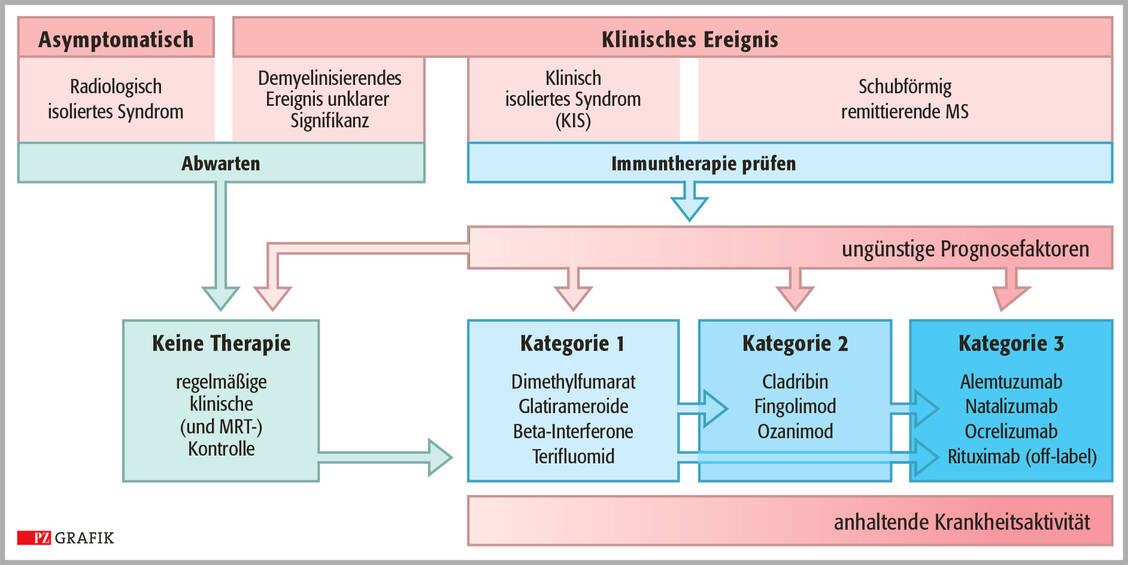
Die neue MS-Leitlinie (1) behandelt auch die deutlich seltener auftretenden, mit MS verwandten Pathologien Neuromyelitis-optica-Spektrum-Erkrankungen (NMOSD) und MOG-IgG-assoziierte Erkrankungen.
NMOSD betreffen in Deutschland circa 1500 bis 2000 Personen, Frauen sind deutlich häufiger betroffen. Der Erkrankungsbeginn liegt später als bei MS. Meist sind das Rückenmark und der Sehnerv von den Entzündungen betroffen, die schubförmig auftreten und sich im Unterschied zur MS oft nicht vollständig zurückbilden. Kennzeichnend sind Autoantikörper gegen Aquaporin-4-Kanäle auf Astrozyten sowie hohe IL-6-Konzentrationen. Häufige Symptome sind Sehstörungen, Bewegungs- und Sensibilitätsstörungen. Spezifisch für NMOSD zugelassen sind der gegen den Komplementfaktor C5 gerichtete Antikörper Eculizumab sowie der IL-6-Rezeptor-Antikörper Satralizumab, der seit Sommer 2021 im Handel ist.
MOG-IgG-assoziierte Erkrankungen sind eine eigenständige Entität, die durch das Auftreten von Immunoglobulin-G-(IgG)-Antikörpern gegen das Myelin-Oligodendrozyten-Glykoprotein (MOG-IgG) gekennzeichnet ist. Die Symptome sind ähnlich wie bei NMOSD, allerdings sind die Manifestationen weiter gefasst und umfassen beispielsweise auch Enzephalitiden. Es gibt keine kontrollierten Studien oder spezifisch für diese Erkrankungen zugelassenen Therapeutika. Eine Behandlung mit Beta-Interferonen, Glatirameroiden oder Alemtuzumab sollte vermieden werden, da diese keine oder sogar negative Wirkungen haben.