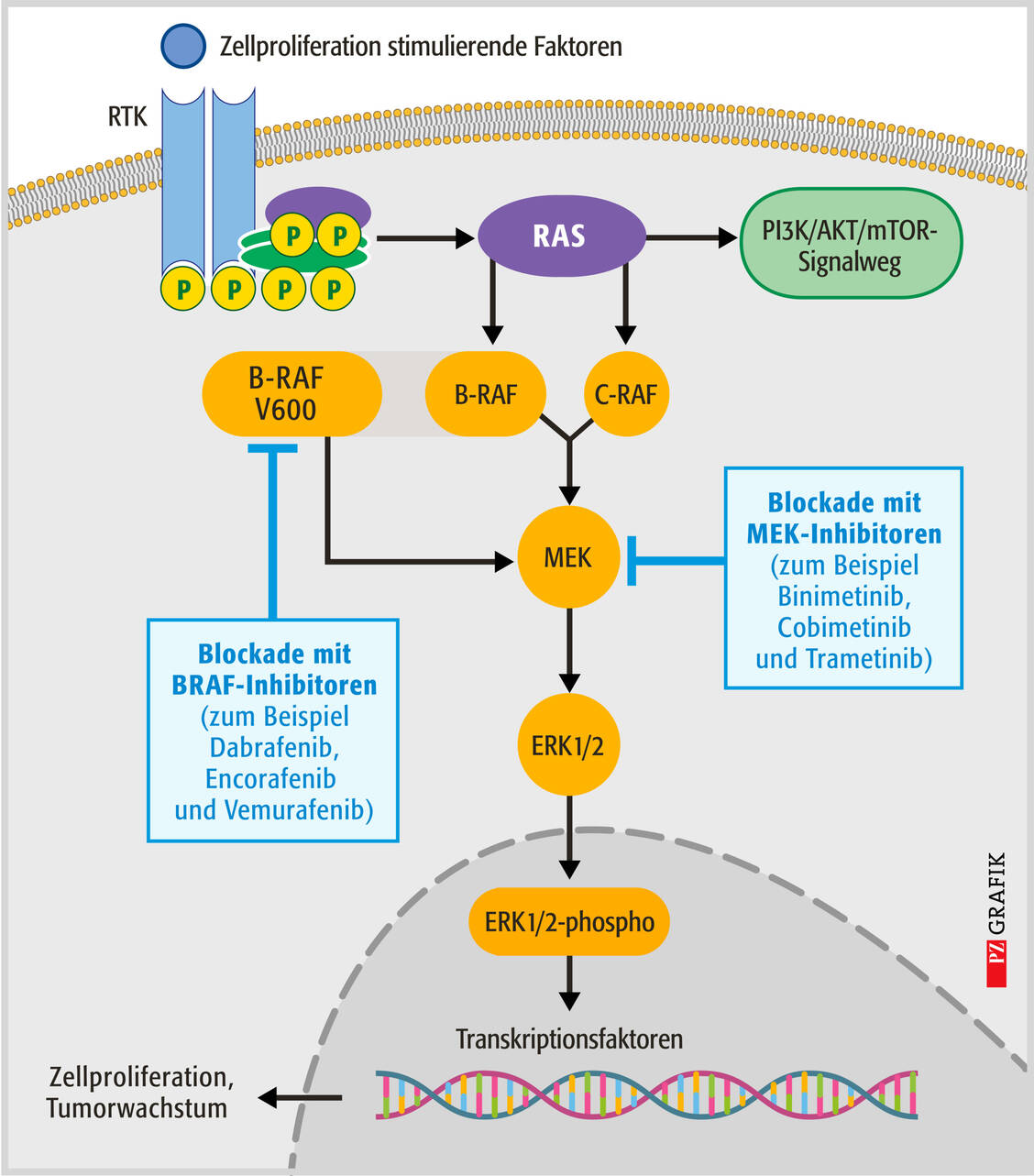
Peter Ruth studierte Pharmazie an der ETH Zürich und der Universität Heidelberg und wurde 1985 dort promoviert. Nach Tätigkeit in der Krankenhausapotheke des Bundeswehrzentralkrankenhauses in Koblenz und Postdoc-Aufenthalten habilitierte er sich im Fach Pharmakologie und Toxikologie an der Medizinischen Fakultät der TU München und war dort als C3-Professor tätig. 2001 erhielt er den Ruf auf den Lehrstuhl für Pharmakologie, Toxikologie und Klinische Pharmazie am Pharmazeutischen Institut der Universität Tübingen.
Katharina Sander hat an der Eberhardt-Karls-Universität Tübingen Pharmazie studiert und erhielt Anfang dieses Jahres die Approbation. Gleichzeitig schloss sie ihr Masterstudium mit einer Masterarbeit unter der Ägide von Professor Dr. Lutz Heide mit dem Titel »Studie zur Qualität von Arzneimitteln aus Nigeria« ab. Sie arbeitet in einer öffentlichen Apotheke in Ostfildern.