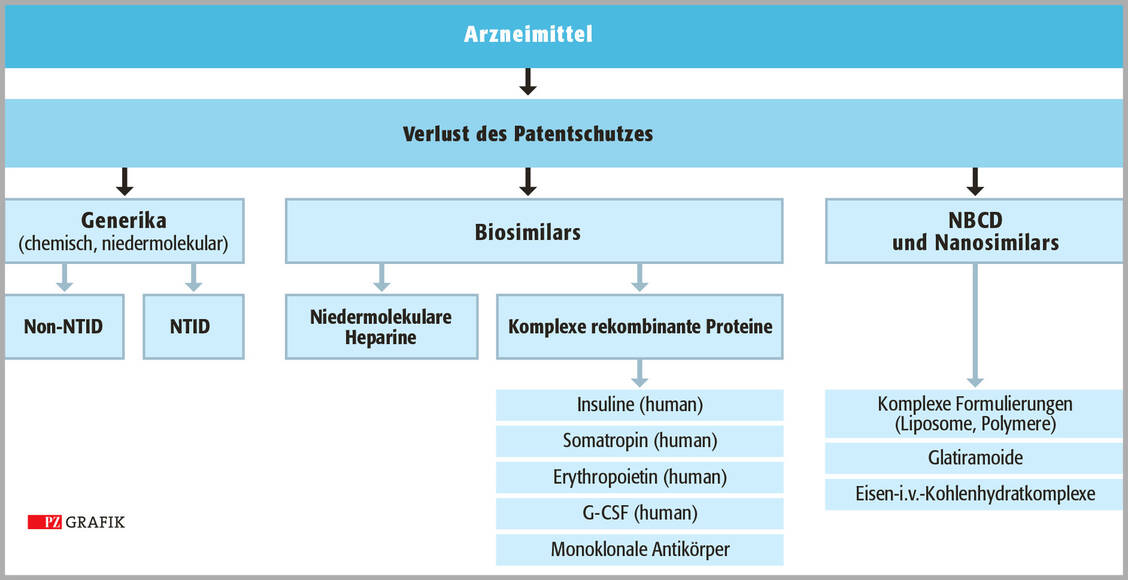
Um es noch einmal zusammenzufassen: Das NBCD Glatiramer ist als Ergebnis eines komplexen synthetischen Herstellungsverfahrens zu verstehen, wobei die einzelnen Herstellungsschritte am Ende entscheidenden Einfluss auf die genaue Zusammensetzung des Endprodukts haben.
Eine Bioäquivalenz-Prüfung wie bei einer Generika-Zulassung ist nicht durchführbar, da die einzelnen Polypeptide im Plasma nicht erfasst werden können. Der Nachweis einer Immunmodulation auf der Basis von Surrogatparametern bei gesunden Probanden hätte wiederum eine zu ungenaue Aussagekraft für die Anwendung bei Multipler Sklerose (MS) zur Folge gehabt.
Damit wurde letztendlich der Weg für eine Hybridzulassung geebnet; in diesem Fall wurde – im Gegensatz zu einer Generika-Zulassung – eine Phase-III-Vergleichsstudie gegenüber dem Referenzarzneimittel Copaxone® für die Zulassung des Nachfolgepräparats (zum Beispiel Clift®) von der EMA verpflichtend vorgeschrieben, ähnlich wie bei den Biosimilars (7–9, 25).