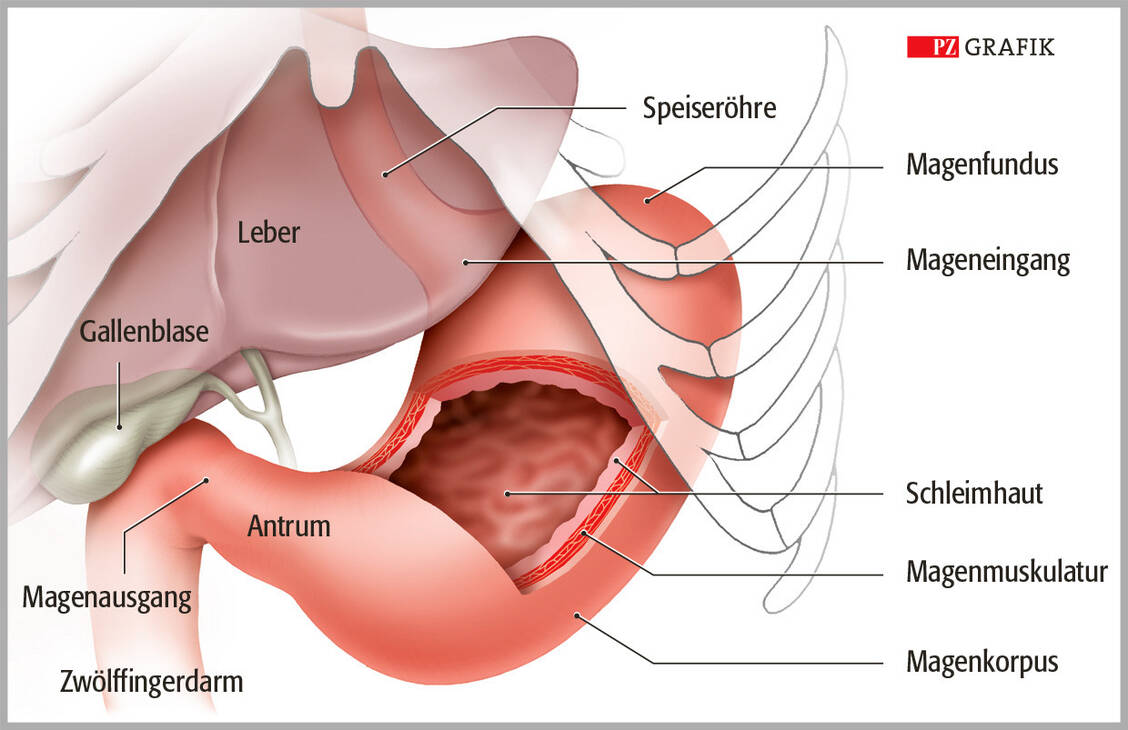
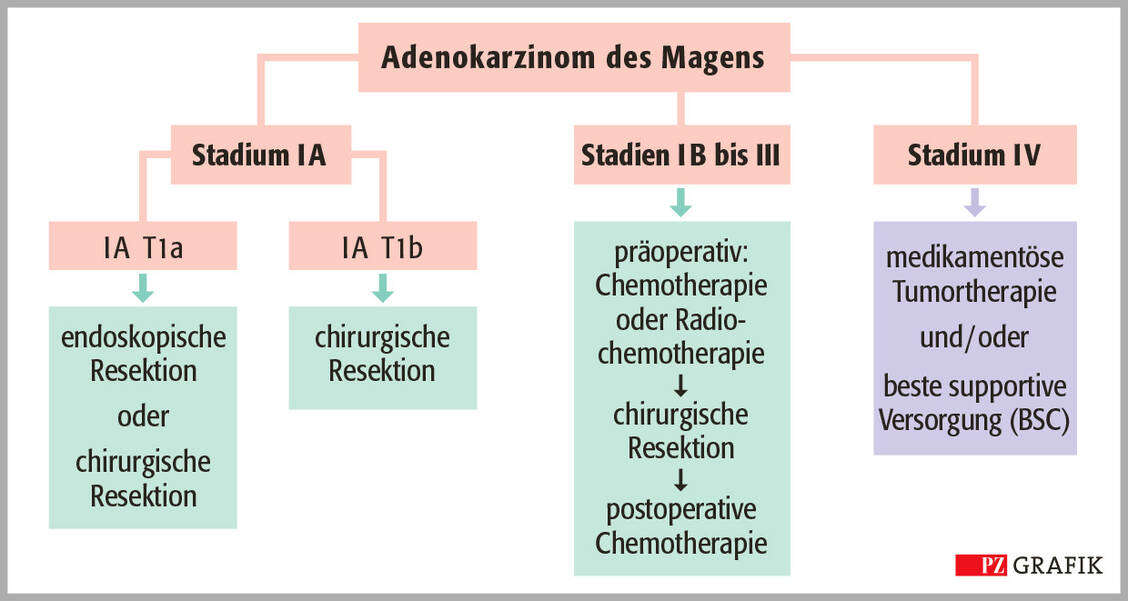
Für die Therapieauswahl ist das Stadium des Magenkarzinoms entscheidend (0 bis IV). Es wird anhand der Eigenschaften des Tumors (T), der betroffenen Lymphknoten (N für »node«) und möglicher Metastasen (M) ermittelt (TNM-Klassifikation). Beim Tumor selbst unterscheidet man, ob er die Magenschleimhaut nur oberflächlich infiltriert (T1) oder bereits die darunterliegenden Schichten angegriffen hat (T1a/b, T2, T3, T4a/b).
Die Einteilung der Lymphknoten richtet sich danach, wie viele von Metastasen betroffen sind: entweder keine regionalen Lymphknotenmetastasen (N0), Metastasen in einem bis zwei Lymphknoten (N1), in drei bis sechs (N2) oder in sieben oder mehr Lymphknoten (N3). Fernmetastasen (M) werden nach ihrem Vorhandensein (M1) oder Fehlen (M0) eingeteilt. Anhand dieser Klassifikation lässt sich das Magenkarzinom in die Stadien 0 bis IV unterteilen, wobei die Stadien I, II und III weiter differenziert werden in I A/B/C, II A/B und III A/B/C.