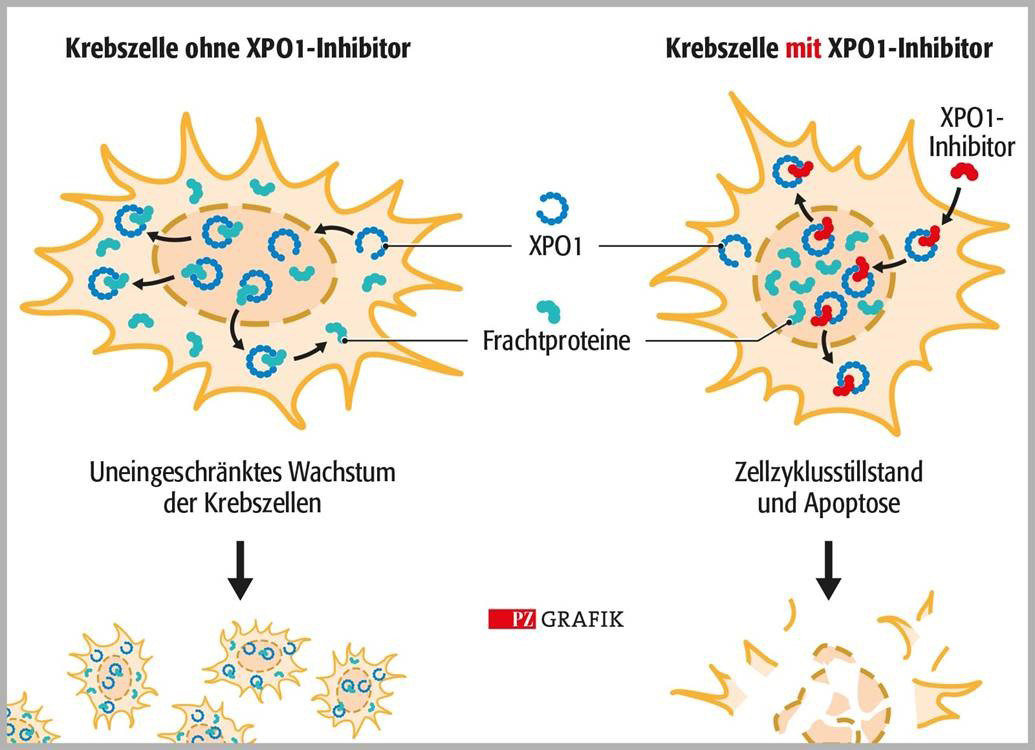
Der Krankheitsverlauf beim Multiplen Myelom ist geprägt von Rezidiven, die auf vorherige Therapien schlecht oder gar nicht ansprechen. In der Erstlinie erzielt der Einsatz von Drei- oder Vierfachkombinationen gute Resultate, in der Zweitlinie wird dadurch allerdings der Klassenwechsel erschwert. Viele unterschiedliche Wirkstoffklassen als Therapieoptionen zu haben, ist also wichtig und die Einführung einer neuen Klasse stellt daher ein äußerst willkommenes Ereignis dar.
Selinexor als erster XPO1-Inhibitor kann vorläufig als Sprunginnovation gesehen werden. Erste Untersuchungen legen die Vermutung nahe, dass die Inhibition von XPO1 bestehende Resistenzen gegen einige Wirkstoffklassen schwächen kann. Auch das wäre ein großer Gewinn.
Insbesondere die Zulassungserweiterung für Selinexor in der Zweitlinientherapie in Kombination mit Bortezomib und Dexamethason ist zu nennen. Ergebnisse der BOSTON-Studie zeigen zwar keine riesengroße Verlängerung des progressionsfreien Überlebens. Der Unterschied zur Gruppe, die nur Bortezomib und Dexamethason erhielt, ist aber signifikant. Jedoch ist das Nebenwirkungspotenzial von Selinexor nicht zu unterschätzen. Gut, dass die Substanz in der Zweitlinie nur einmal wöchentlich zum Einsatz kommt. In der Fünftlinientherapie in Kombination mit Dexamethason wird Selinexor hingegen zweimal wöchentlich verabreicht.
Das Target von Selinexor ist auch für die Behandlung anderer Krebserkrankungen interessant. In den USA ist der Wirkstoff bereits beim diffus großzelligen B-Zell-Lymphom zugelassen und erst kürzlich hat Selinexor die EU-Zulassung zur Behandlung von Myelofibrose als Arzneimittel für seltene Leiden erhalten. Zudem laufen Studien bei bestimmten anderen Lymphomen und Sarkomen.
Sven Siebenand, Chefredakteur