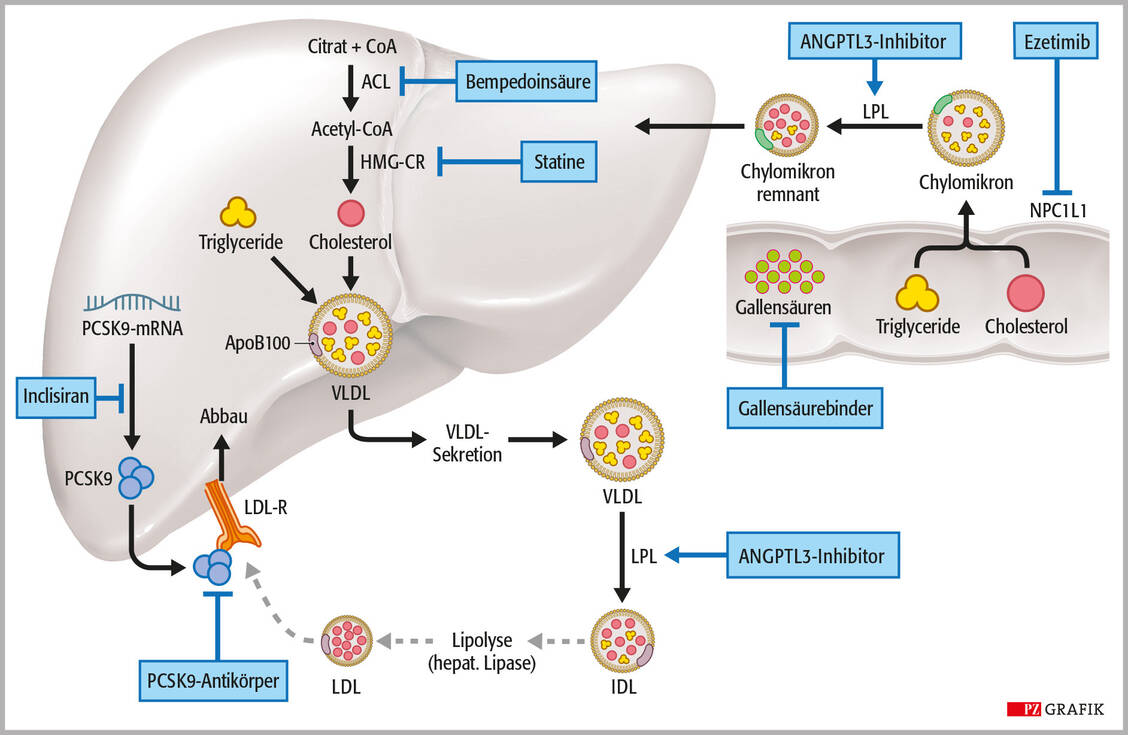
Volanesorsen ist indiziert für die Behandlung von Patienten mit familiärem Chylomikronämie-Syndrom (FCS). Die seltene, genetisch bedingte extreme Hypertriglyzeridämie geht auf Mutation der Lipoproteinlipase (oder assoziierter Gene) zurück. Bei den Patienten ist der Abbau von Chylomikronen stark gestört, was zu massiven Triglycerid-Erhöhungen führt (über 800 mg/dl) und das Risiko für eine Pankreatitis stark erhöht.
Volanesorsen ist ein synthetisches Antisense-Oligonukleotid, das gezielt die Expression von Apolipoprotein C-III (ApoC3) hemmt, einem wichtigen Inhibitor der Lipolyse. Nach subkutaner Applikation gelangt Volanesorsen über den Blutkreislauf in die Leberzellen, wo es durch Hybridisierung mit der ApoC3-mRNA die Translation dieses Proteins über RNAse-H-vermittelten mRNA-Abbau verhindert. Volanesorsen wirkt unabhängig von der Lipoproteinlipase-Aktivität. Dadurch sinkt das Risiko für eine Pankreatitis deutlich, insbesondere bei Triglycerid-Konzentrationen über 800 mg/dl. Eine wöchentliche Kontrolle der Thrombozytenzahl ist erforderlich, bei kritischem Abfall ist die Therapie zu unterbrechen.