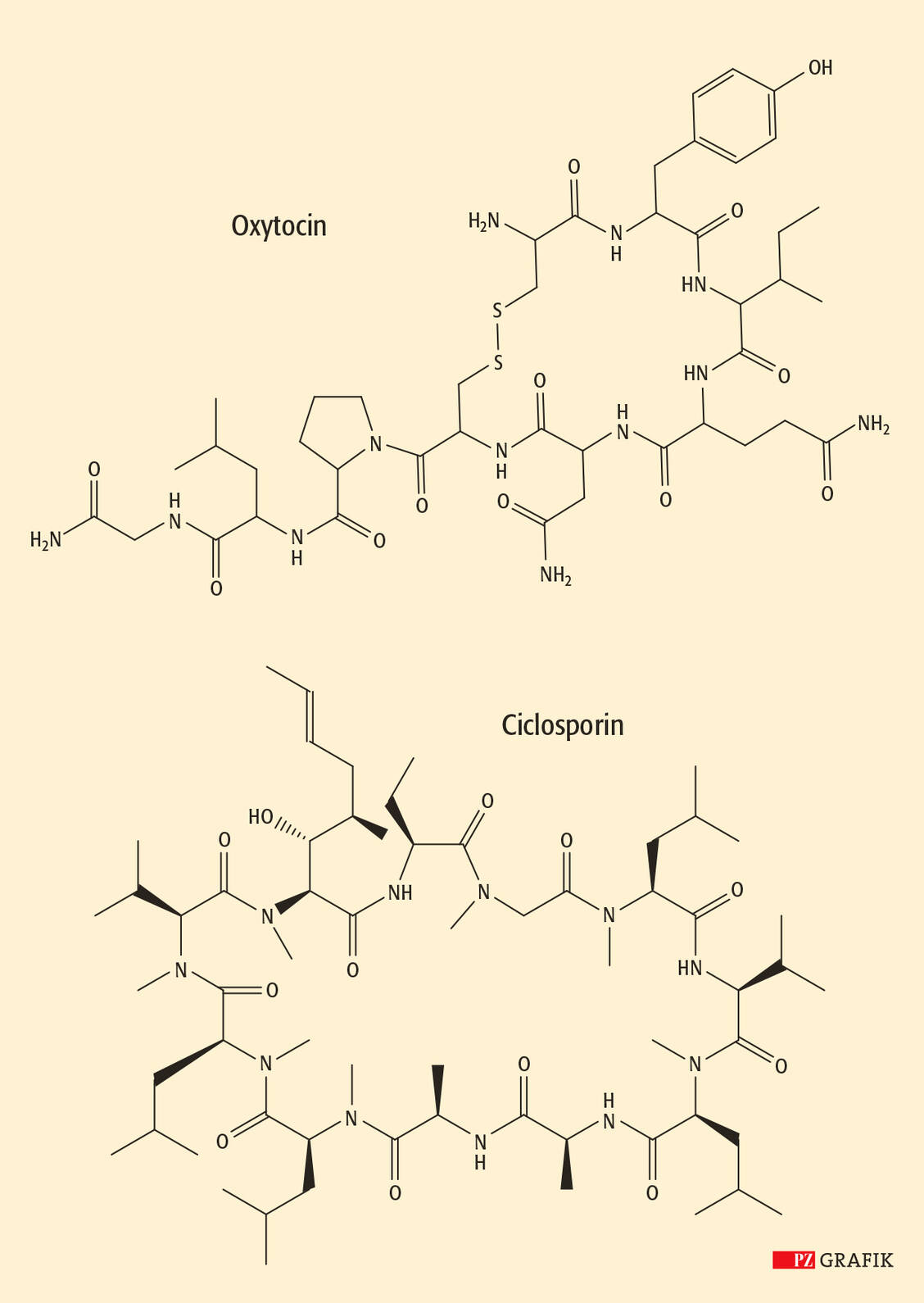
Weiterhin können funktionelle Gruppen der Seitenketten mit dem N- oder C-Terminus reagieren (»Head-to-Sidechain«, »Sidechain-to-Tail«). Auch Seitenketten sind miteinander zyklisierbar; typisch ist hier die Bildung einer Disulfid-Brücke zwischen zwei Cysteinen (7).
Verwendet man Spiegelbildisomere (Enantiomere) der L-Aminosäuren zur Synthese, resultieren Peptide mit gleichen physikochemischen Eigenschaften, die aber nicht von Peptidasen erkannt werden. Auch eine N-Methylierung unterbindet durch sterische Hinderung die enzymatische Hydrolyse der Peptidbindung.
Eine weitere Limitation von Peptidtherapeutika ist deren kurze Halbwertszeit in vivo durch eine ausgeprägte renale Filtration (Tabelle 1). Diese kann reduziert werden durch die Konjugation des Peptids mit Makromolekülen wie PEG-Polymeren. Eine weitere häufig genutzte Strategie ist die Konjugation mit Fettsäuren, die eine Bindung an Albumin vermitteln und somit das Peptid vor der renalen Filtration schützen (17). Beispiele sind die GLP-1-Analoga Liraglutid (C16-Fettsäure) und Semaglutid (PEG-Spacer und C18-Dicarbonsäure) sowie Insulin Detemir (C14-Fettsäure) und Insulin Degludec (C16-Fettsäure). Bei all diesen Peptiden führt die Modifikation zu einer längeren Zirkulationshalbwertszeit. Sie müssen daher nur einmal täglich bis zu einmal wöchentlich gespritzt werden.