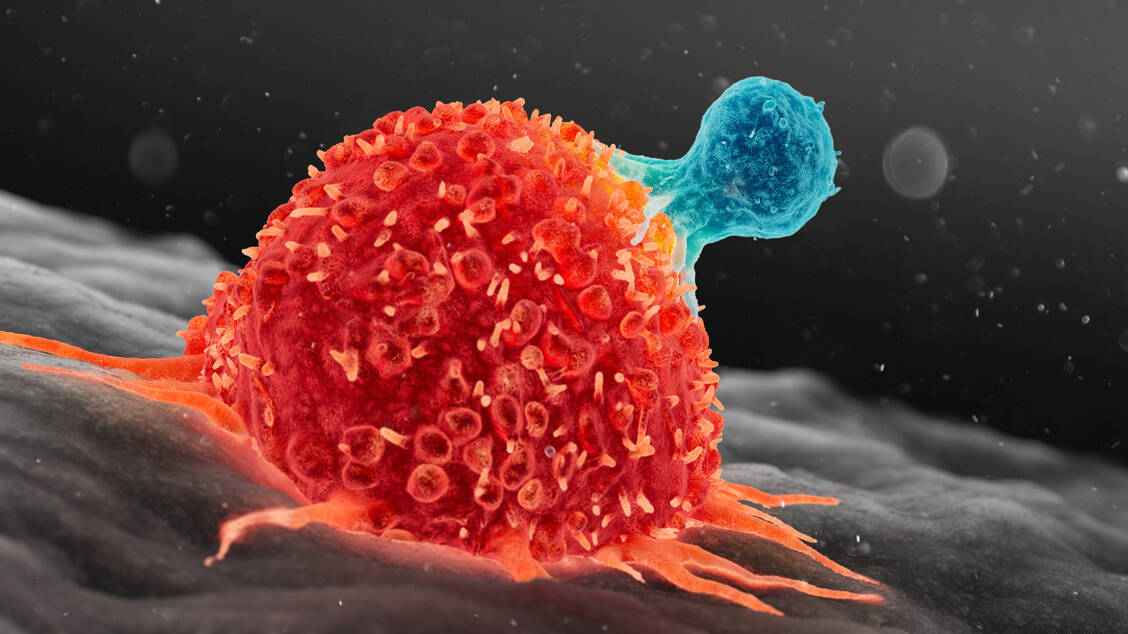
Als Ausgangspunkt zur Herstellung der von den Forschenden als dTyU19 bezeichneten Zellen dienten periphere mononukleäre Blutzellen einer gesunden Spenderin. Aus diesen wurden T-Zellen isoliert, die zunächst mit einem lentiviralen Vektor transduziert wurden, in den ein Gen für einen Anti-CD19-CAR-T-Rezeptor einkloniert war. Anschließend wurden durch CRISPR/Cas-9 induzierte Mutagenese fünf Gene inaktiviert, darunter die Gene für HLA-A und HLA-B, für den Class II MHC-Transaktivator (CIITA), für die konstante Domäne der T-Zell-Rezeptor-Alpha-Untereinheit (TRAC) und das für den PD-1-Rezeptor. Anschließend wurden Zellen selektioniert, die kein CD3-Protein exprimieren, um eine Graft-versus-Host-Reaktion (GvHR) durch die allogenen T-Zellen zu vermeiden. Bei einer GvHR erkennen die Immunzellen des Spenders die Körperzellen des Empfängers als fremd und greifen diese an.