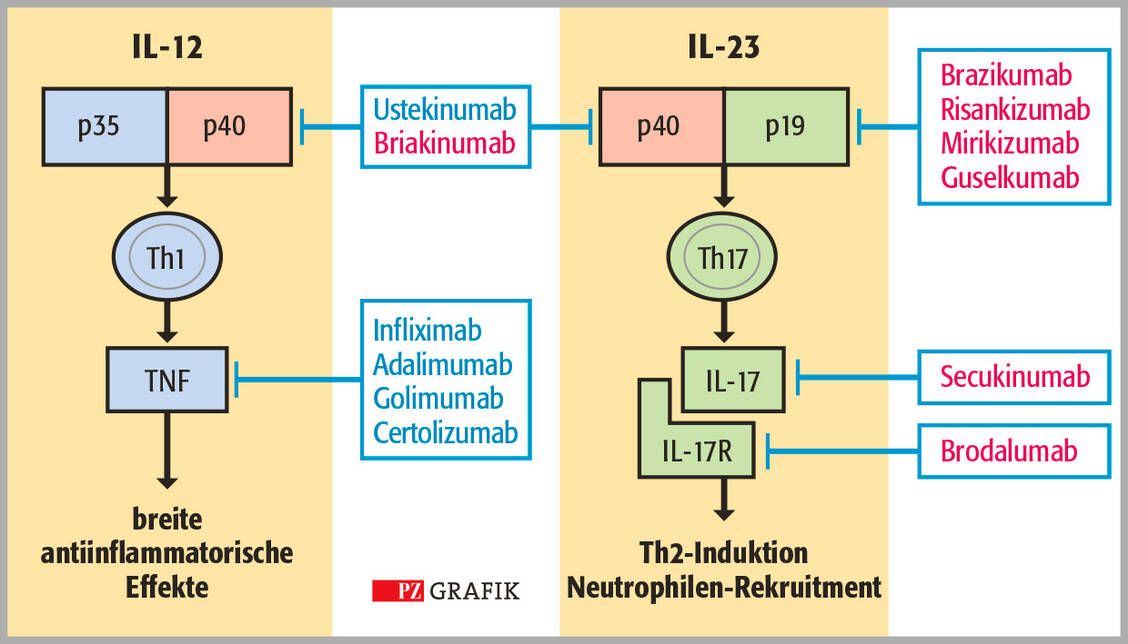
Haben die Patienten mit Anti-TNF-Präparaten eine Remission erreicht, sollte diese Medikation (als Monotherapie, also ohne Immunsuppressiva) fortgesetzt werden. Für den Remissionserhalt gab es keine statistisch signifikanten Unterschiede zwischen Infliximab, Adalimumab und Certolizumab Pegol (14, 15).
Vergleichbares gilt für Vedolizumab und Ustekinumab: Patienten mit mittelschwerem bis schwerem MC, die damit eine Remission erreicht haben, bekommen die Antikörper weiterhin zur Erhaltungstherapie (16).
Immunsuppressiva und biologische Wirkstoffe sind die wirksamsten Therapeutika zur Aufrechterhaltung einer medizinisch induzierten Remission bei mittelschwerem bis schwerem Morbus Crohn. Aminosalicylate und Steroide werden in dieser Erkrankungsphase nicht empfohlen.