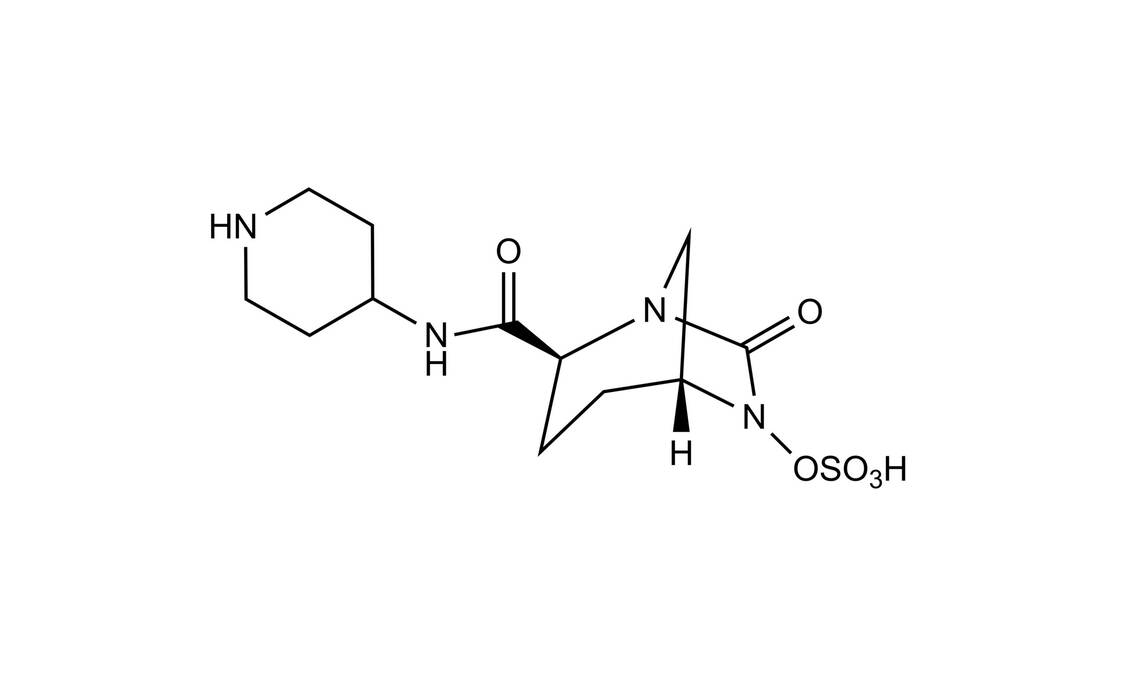
Die Zulassung basiert auf den Phase-III-Studien RESTORE-IMI 1 und RESTORE-IMI 2. RESTORE-IMI 1 verglich Recarbrio mit der Kombination Colistin/Imipenem/Cilastatin an 47 Patienten, die an Infektionen durch Imipenem-unempfindliche bakterielle Erreger litten. Patienten mit HAP oder VAP, komplizierten intraabdominalen Infektionen oder komplizierten Harnwegsinfektionen erhielten randomisiert Recarbrio oder die Vergleichskombination. Die Therapie dauerte bei Pneumonien 7 bis 21 Tage, bei intraabdominalen oder Harnwegsinfektionen 5 bis 21 Tage. Primärer Endpunkt war das klinische Gesamtansprechen, definiert anhand relevanter Endpunkte für jeden Infektionstyp in der mikrobiologisch modifizierten Intention-to-Treat-Population (mMITT). Dies waren Patienten, bei denen ein für den Studieneinschluss relevanter Erreger nachweisbar war und die mindestens eine Dosis der Studientherapie erhalten hatten. Von den 47 Patienten erfüllten 31 die mMITT-Kriterien. Den primären Endpunkt erreichten 71,4 Prozent der Recarbrio-Gruppe und 70,0 Prozent der Kontrollgruppe.