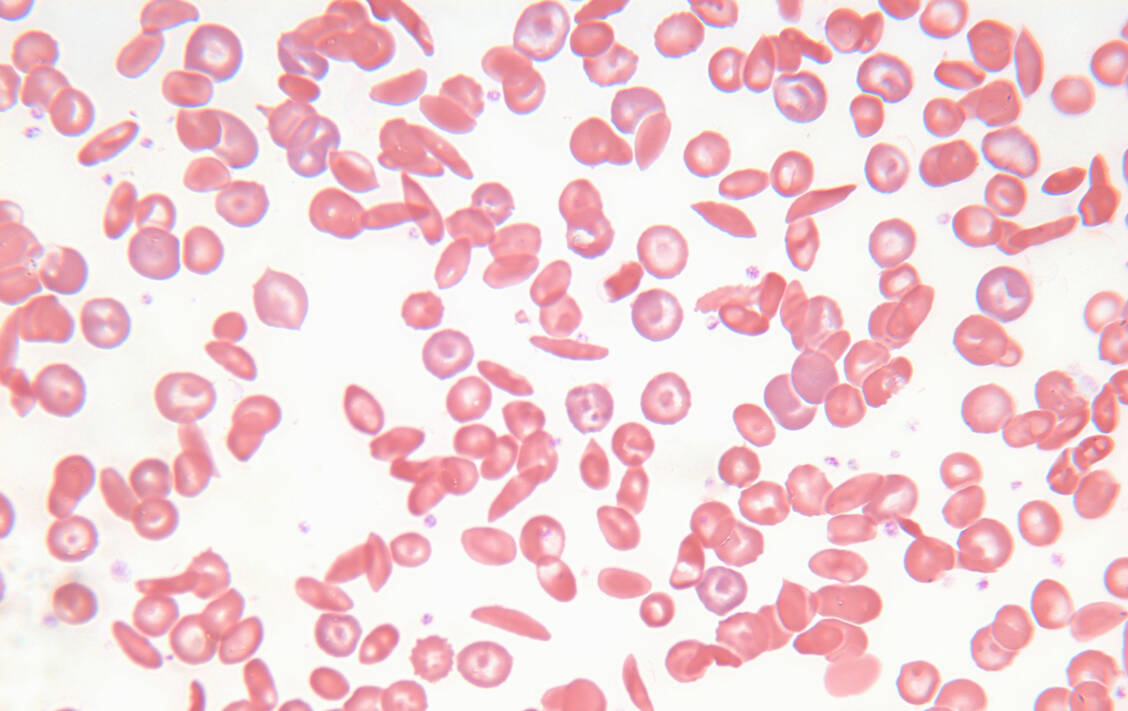
Die β-Thalassämie ist ebenfalls eine genetische Erkrankung. Kennzeichnend ist eine zu geringe oder fehlende Produktion von β-Globin, einem wichtigen Baustein des Hämoglobins; daraus resultiert eine Anämie. Menschen mit schwerer β-Thalassämie sind ihr Leben lang auf Bluttransfusionen angewiesen und haben ebenfalls eine stark reduzierte Lebenserwartung.
Im Rahmen der Gentherapie werden den Patienten die eigenen Stamm- und Vorläuferzellen entnommen und diese ex vivo mit Exa-cel behandelt – die Genschere kommt zum Einsatz. Die sogenannte Erythroid-spezifische Enhancer-Region des BCL11A-Gens wird durch einen präzisen Doppelstrangbruch modifiziert. Das hat zur Folge, dass ein Gen reaktiviert wird, das normalerweise nach der Geburt stillgelegt wird. Werden die modifizierten Zellen dem Patienten zurückinfundiert, produzieren die daraus gebildeten roten Blutkörperchen nun die fetale Hämoglobin-Variante (Hämoglobin F). Sie soll die deformierten Hämoglobin-Varianten ersetzen.