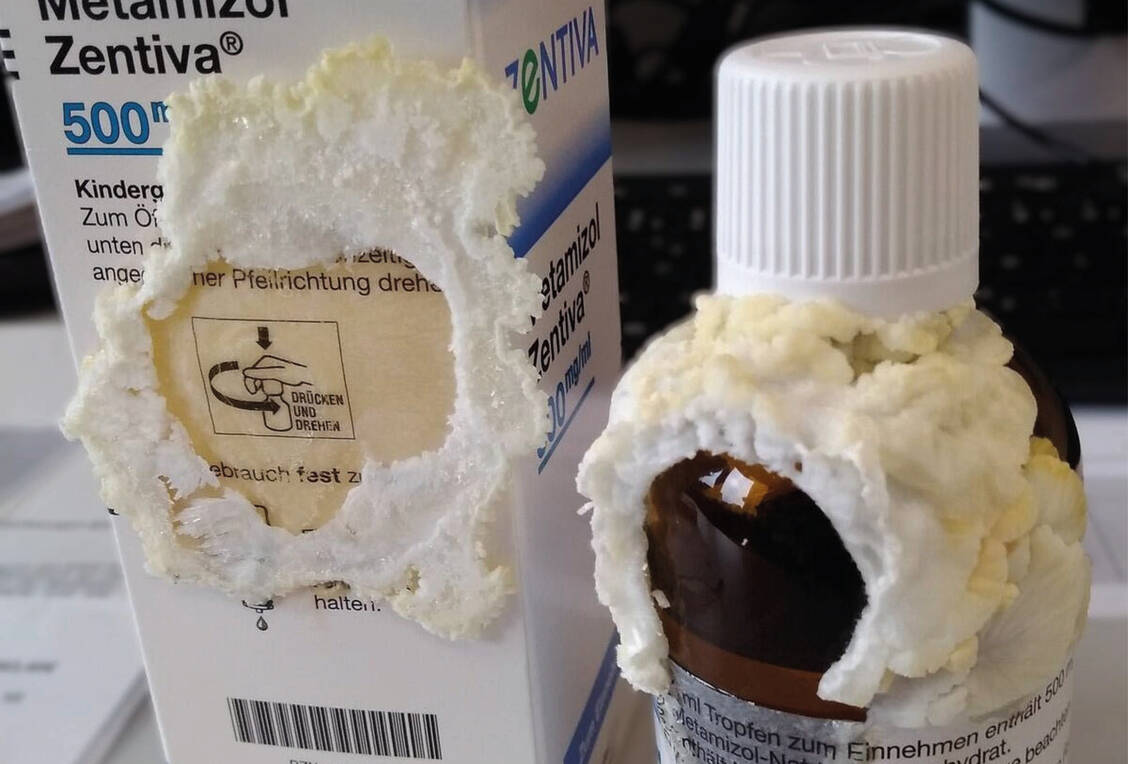
Vor allem werden Auskristallisationen der Metamizol-Lösung beobachtet, am Flaschenhals, unterhalb des (ungeöffneten) Deckels, in der Tropfmontur sowie zwischen Tropfmontur und Flaschenhals. Verfallsdatum und Chargennummer sind zum Teil verwischt und unlesbar. Manchmal lassen sich die Flaschen schwer öffnen oder die Verpackung ist gar mit ausgetretener Wirkstofflösung getränkt. Betroffen waren unterschiedliche Chargen und alle Packungsgrößen.
Zentiva stufte die berichteten Qualitätsmängel als berechtigt ein und verspach entsprechende Korrektur- und Präventionsmaßnahmen. Die AMK ist damit jedoch nicht zufrieden. Sie übt in einer heute veröffentlichten Information scharfe Kritik an dem Hersteller und fürchtet im Gegensatz zu diesem auch gesundheitliche Folgen für die Patienten. Diese könnten etwa in einer verzögerten Schmerztherapie oder in einer verminderten Wirksamkeit beziehungsweise einer unzureichenden Schmerzlinderung durch Dosierschwierigkeiten bestehen.