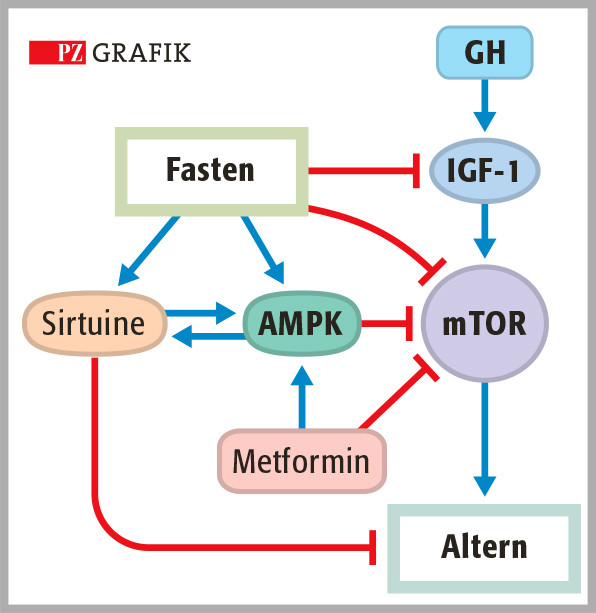
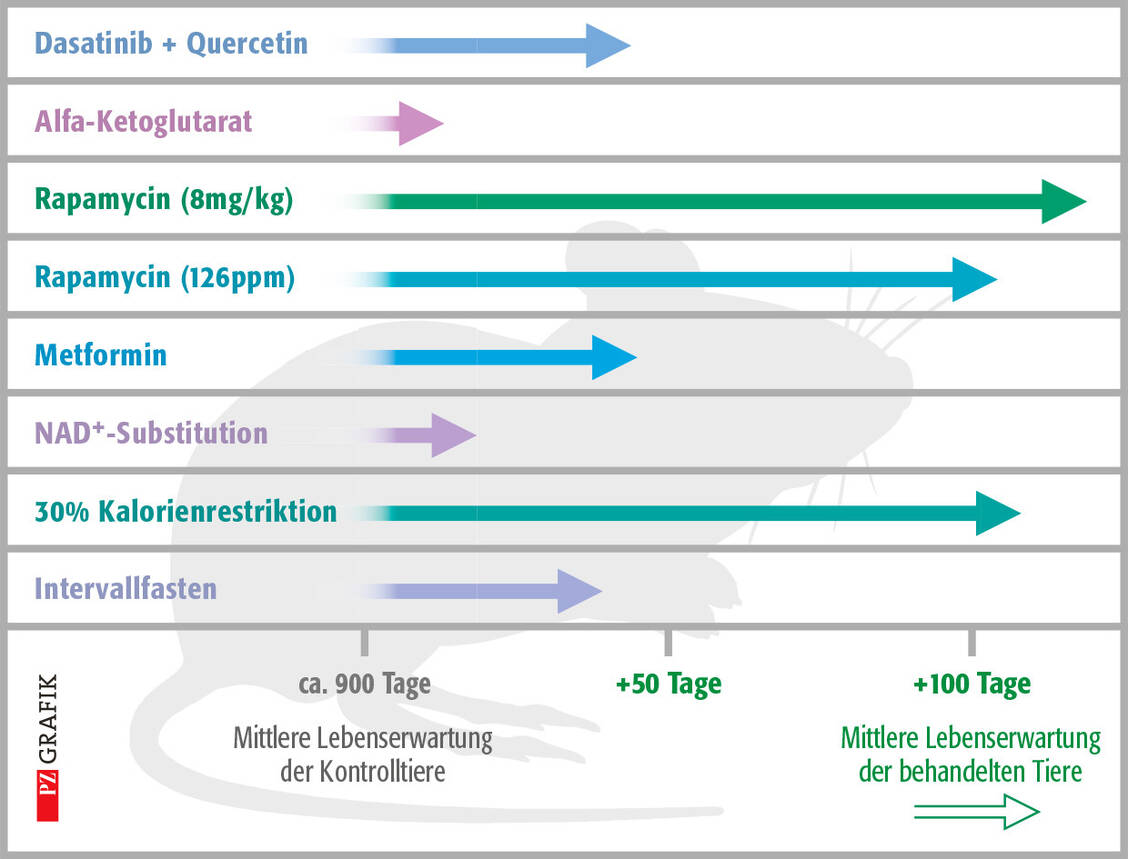
Unter den Maßnahmen »Fasten«, »Intervallfasten«, »zeitlich begrenzte Ernährung« und »Kalorienreduktion« zeigt das Fasten bei Weitem den größten Effekt. Vor allem kommt es bei zeitlich begrenztem Fasten reproduzierbar zu einem gewissen »Reset« wichtiger Funktionen: Das Immunsystem wird gestärkt, seneszente Zellen werden verstärkt eliminiert und Sirtuine (Histondeacetylasen, HDAC, die wichtige Funktionen der DNA kontrollieren) werden aktiviert.
Bei anderen Methoden der Lebensstilanpassung steht zumindest zu Beginn die Reduktion des Körpergewichts im Vordergrund. Dies resultiert vor allem aus einer Einschränkung der Kalorienzufuhr. Eine zeitliche Begrenzung der täglichen Nahrungsaufnahme kann diesen Effekt noch steigern, denn es hilft, sich konsequent an die Vorgaben der Diät zu halten. Darüber hinaus zeigen Versuche mit Mäusen, dass eine Kalorienreduktion im Verbund mit eingeschränkten Fresszeiten erstaunliche Zusatzeffekte entfalten kann.