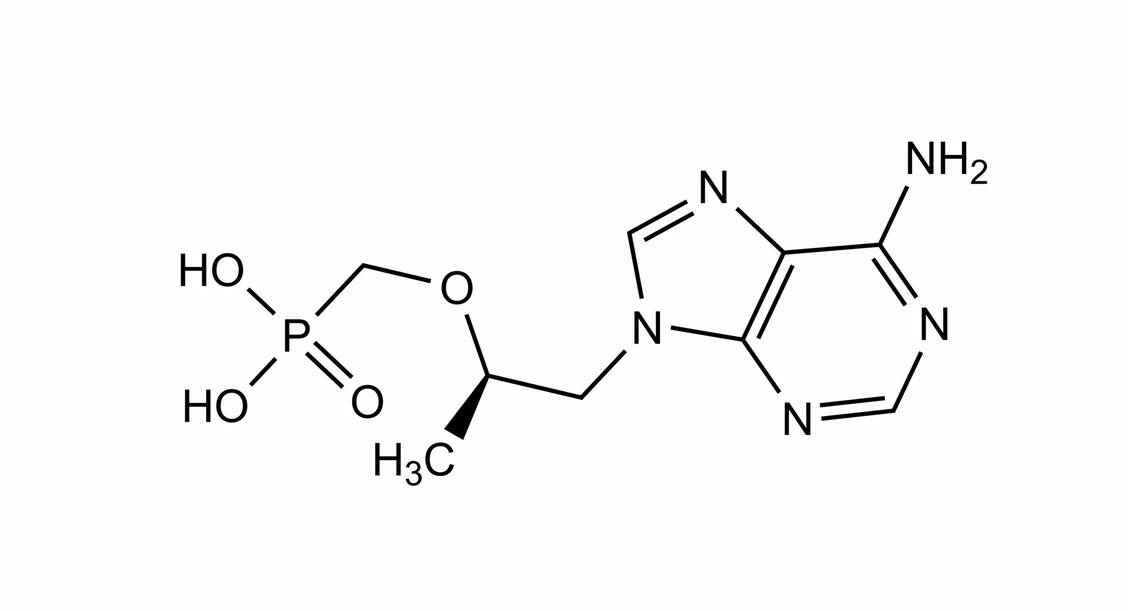
Tenofovir gilt als relativ gut verträglich. Zu den häufigsten Nebenwirkungen gehören etwa Kopfschmerzen, Schwindel, gastrointestinale Beschwerden, Hautausschlag, Erschöpfung oder erhöhte Transaminasen.
Unter Tenofovirdisoproxil kann es in seltenen Fällen zu Nierenversagen und gelegentlich zu proximaler renaler Tubulopathie, manchmal mit nachfolgenden Knochenanomalien, kommen. Eine Überwachung der Nierenfunktion ist empfohlen. Das gilt auch für Tenofoviralafenamid, sofern klinisch angemessen. Aufgrund der niedrigeren Konzentrationen in renalen Epithelzellen infolge der niedrigeren Dosierung gelten das nephrotoxische Potenzial und das Risiko für Knochenschäden bei dem Alafenamid-Prodrug jedoch als geringer.